题目内容
【题目】![]() 可用作食品添加剂。
可用作食品添加剂。![]() 能发生以下反应:
能发生以下反应:
![]()
![]() 淡黄色
淡黄色![]()
某化学兴趣小组进行以下探究。回答有关问题:
![]() 制取
制取![]()
反应原理:![]()
![]()
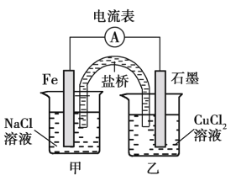
用如图所示装置进行实验。
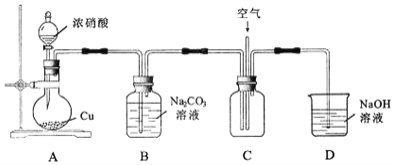
![]() 铜与浓硝酸反应的离子方程式为______。
铜与浓硝酸反应的离子方程式为______。
![]() 实验过程中,需控制B中溶液的
实验过程中,需控制B中溶液的![]() ,否则产率会下降,理由是______。
,否则产率会下降,理由是______。
![]() 往C中通入空气的目的是______
往C中通入空气的目的是______![]() 用化学方程式表示
用化学方程式表示![]() 。
。
![]() 反应结束后,B中溶液经蒸发浓缩、冷却结品、______等操作,可得到粗产品晶体和母液。
反应结束后,B中溶液经蒸发浓缩、冷却结品、______等操作,可得到粗产品晶体和母液。
![]() 测定粗产品中
测定粗产品中![]() 的含量
的含量
称取mg粗产品,溶解后稀释至![]() 取出
取出![]() 溶液,用
溶液,用![]() 酸性溶液平行滴定三次,平均消耗的体积为VmL。
酸性溶液平行滴定三次,平均消耗的体积为VmL。
已知:![]()
![]() 稀释溶液时,需使用的玻璃仪器除烧杯、玻璃棒外,还有______
稀释溶液时,需使用的玻璃仪器除烧杯、玻璃棒外,还有______![]() 填标号
填标号![]() 。
。
A.容量瓶![]() 量筒
量筒![]() 胶头滴管
胶头滴管![]() 锥形瓶
锥形瓶
![]() 当观察到______时,滴定达到终点。
当观察到______时,滴定达到终点。
![]() 粗产品中
粗产品中![]() 的质量分数为______
的质量分数为______![]() 用代数式表示
用代数式表示![]() 。
。
![]() 设计实验方案证明母液中含有
设计实验方案证明母液中含有![]() ______
______![]() 限选用的试剂:硝酸、硝酸银溶液、硝酸钡溶液、氯化钡溶液
限选用的试剂:硝酸、硝酸银溶液、硝酸钡溶液、氯化钡溶液![]() 。
。
【答案】![]() 如果
如果![]() ,亚硝酸盐会转化为硝酸盐和NO气体
,亚硝酸盐会转化为硝酸盐和NO气体 ![]() 过滤 A、C 溶液出现粉红色,且半分钟内不褪色
过滤 A、C 溶液出现粉红色,且半分钟内不褪色 ![]() 取样,加硝酸,若有气泡产生,且生成的气体遇空气变红棕色,证明含有
取样,加硝酸,若有气泡产生,且生成的气体遇空气变红棕色,证明含有![]()
【解析】
(1)①铜与浓硝酸反应生成硝酸铜、二氧化氮和水;
②3NO2-+2H+=NO3-+2NO↑+H2O 分析判断;
③空气中氧气和一氧化氮反应生成二氧化氮;
④溶液中得到溶质晶体的方法是浓缩蒸发、冷却结晶、过滤洗涤、干燥等操作得到;
(2)①称取mg粗产品,溶解后稀释至250mL是配制溶液,结合配制溶液的步骤选择仪器;
②高锰酸钾溶液为紫红色,利用溶液颜色判断反应终点;
③2MnO4-+6H++5NO2-=5NO3-+2Mn2++3H2O,结合反应定量关系计算;
(3)3NO2-+2H+=NO3-+2NO↑+H2O,2NO+O2=2NO2,结合反应最后生成红棕色气体二氧化氮检验。
![]() 铜与浓硝酸反应生成硝酸铜、二氧化氮和水,反应的离子方程式为:
铜与浓硝酸反应生成硝酸铜、二氧化氮和水,反应的离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 实验过程中,需控制B中溶液的
实验过程中,需控制B中溶液的![]() ,否则产率会下降,理由是如果
,否则产率会下降,理由是如果![]() ,
,![]() ,亚硝酸盐会转化为硝酸盐和NO气体,故答案为:如果
,亚硝酸盐会转化为硝酸盐和NO气体,故答案为:如果![]() ,亚硝酸盐会转化为硝酸盐和NO气体;
,亚硝酸盐会转化为硝酸盐和NO气体;
![]() 往C中通入空气的目的是一氧化氮和氧气反应生成二氧化氮,反应的化学方程式为:
往C中通入空气的目的是一氧化氮和氧气反应生成二氧化氮,反应的化学方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 反应结束后,B中溶液经蒸发浓缩、冷却结晶、过滤等操作,可得到粗产品晶体和母液,故答案为:过滤;
反应结束后,B中溶液经蒸发浓缩、冷却结晶、过滤等操作,可得到粗产品晶体和母液,故答案为:过滤;
![]() 稀释溶液时,需使用的玻璃仪器除烧杯、玻璃棒外,还有容量瓶、胶头滴管等,故选AC,故答案为:A、C;
稀释溶液时,需使用的玻璃仪器除烧杯、玻璃棒外,还有容量瓶、胶头滴管等,故选AC,故答案为:A、C;
![]() ,高锰酸钾溶液为紫红色,利用溶液颜色判断反应终点,滴入最后一滴,溶液出现粉红色,且半分钟内不褪色,故答案为:溶液出现粉红色,且半分钟内不褪色;
,高锰酸钾溶液为紫红色,利用溶液颜色判断反应终点,滴入最后一滴,溶液出现粉红色,且半分钟内不褪色,故答案为:溶液出现粉红色,且半分钟内不褪色;
![]() 称取mg粗产品,溶解后稀释至
称取mg粗产品,溶解后稀释至![]() 取出
取出![]() 溶液,用
溶液,用![]() 酸性溶液平行滴定三次,平均消耗的体积为VmL。
酸性溶液平行滴定三次,平均消耗的体积为VmL。
![]()
2 5
![]() n
n
![]() ,
,
250ml溶液中所含物质的量![]() ,粗产品中
,粗产品中![]() 的质量分数
的质量分数![]() ,故答案为:
,故答案为:![]() ;
;
![]() ,
,![]() ,结合反应最后生成红棕色气体二氧化氮检验,设计实验方案:取样,加硝酸,若有气泡产生,且生成的气体遇空气变红棕色,证明含有
,结合反应最后生成红棕色气体二氧化氮检验,设计实验方案:取样,加硝酸,若有气泡产生,且生成的气体遇空气变红棕色,证明含有![]() ,故答案为:取样,加硝酸,若有气泡产生,且生成的气体遇空气变红棕色,证明含有
,故答案为:取样,加硝酸,若有气泡产生,且生成的气体遇空气变红棕色,证明含有![]()

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案【题目】某校化学课外研究小组为验证浓硫酸与金属Zn反应产生的气体中含SO2和H2,进行了下列实验活动:
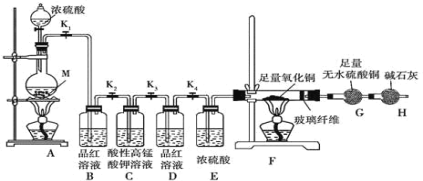
(1)在装入药品前,甲同学需检查装置_____。
(2)填写下表中的实验现象:_____。
装置 | B | F | G |
实验现象 |
(3)装置C的作用是_____,写出装置C中发生反应的离子方程式_____。
(4)装置D的作用是_____。
(5)SO2是大气污染物之一,也是某工业生产中的主要尾气之一。某校兴趣小组欲采用下列方案测定此工业尾气中的SO2的含量。
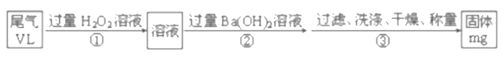
通过的尾气体积为VL(已换算成标准状况)时,该尾气中SO2含量(体积分数)为_____(用含有V、m的代数式表示)。