题目内容
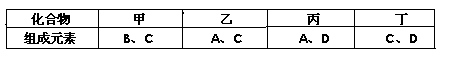
A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素。
| A | |
| | C |
(1)D原子结构示意图为_____________。
(2)将C的低价态氧化物甲通入到D单质的水溶液会使之褪色,体现了甲的________性,写出该反应的离子方程式_____________________。
(3)A的最高价氧化物对应的水化物是乙,现将过量Cu加入到100 mL 8.0 mol/L乙的浓溶液中,充分反应,共收集到6.72L(标准状况)气体,则该气体的成分是_________,还原剂失电子数为_________________。
(4)将两份足量的B单质分别加入到等体积等浓度的盐酸和NaOH溶液中,充分反应生成气体的体积比为__________,若将反应后所得的溶液混合,会生成白色沉淀,发生反应的离子方程式为_____________________________________;B单质表面的氧化膜可用NaOH溶液除去,写出该反应的化学方程式___________________________________。
(1) (2)还原性 、Cl2+SO2+2H2O=4H++2Cl-+SO42- (3)NO 、NO2,0.5NA(4)1:3 ,Al3++3[Al(OH) 4] - =4Al(OH)3↓ Al2O3+2NaOH+3H2O =2Na[Al(OH) 4]
(2)还原性 、Cl2+SO2+2H2O=4H++2Cl-+SO42- (3)NO 、NO2,0.5NA(4)1:3 ,Al3++3[Al(OH) 4] - =4Al(OH)3↓ Al2O3+2NaOH+3H2O =2Na[Al(OH) 4]
解析试题分析:(1)A:N ; B :Al; C:S D:Cl (2)SO2被氯气氧化,Cl2+SO2+2H2O=4H++2Cl-+SO42-(3)因为Cu过量,HNO3由浓变稀,产生的气体为NO2和NO的混合气体。利用N原子守恒。设Cu为amol,则2a+0.3=0.8;可以解出a=0.25mol.转移的电子数为0.5NA。(4)2Al+6H+ =2Al3++3H2↑2Al +2OH- +6 H2O=2[Al(OH) 4] - +3H2↑,在两份足量的Al单质分别加入到等体积等浓度的盐酸和NaOH溶液,利用方程式可以推动1:3 。
考点:元素推断和常见元素性质的考察。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂。 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 | 单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 | 第三周期元素的简单离子中半径最小 |
(2)写出Z原子的核外电子排布式 。
(3)Z的最高价氧化物对应水化物的电离方程式 。
(4)元素T与氟元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目
有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
(1)A原子核外比X原子多3个电子,A的原子结构示意图是 。含lmolX的氧化物晶体中含有共价键数目为 。
(2)Z与钙离子组成的化合物的电子式为 。
(3)14gY完全燃烧放出的热量是141.5kJ,写出Y燃烧的热化学方程式 。
(4)组成W的元素最高价氧化物对应的水化物甲有下图所示转化关系(丁为金属单质,反应条件和其他物质已略)

①写出丁元素在周期表中的位置 。
②写出丁在高温下与水反应的化学方程式 。
③组成W的元素的简单氢化物极易溶于水的主要原因是 ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 。
下表所列是元素周期表部分短周期的主族元素
| | W | X | Y | |
| R | | | | Z |
已知R为地壳中含量最多的金属元素。
(1)写出Z的原子结构示意图________。
(2)W与氢原子形成6原子分子的结构简式_______。
(3)超细RX粉末被应用于大规模集成电路领域。其制作原理为R2Y3、X2、W在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为_______。
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物溶于水中,所得溶液离子浓度从大到小的顺序是_______。
(5)火箭发动机的燃料胼(N2H4)与氧化剂N2O4反应生成N2和水蒸气。
已知①N2(g)+2O2(g)=N2O4(l) △H1=—195kJ?mol—1
②N2H4(l) +O2(g)=N2(g)+2H2O(g) △H2=—534.2kJ?mol—1
写出肼和N2O4反应的热化学方程式______________。
(6)温度为T时,向2.0L恒容密闭容器中充入1.00 mol PCl5,反应PCl5(g)
 PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
相同温度下,起始时向容器中充入1.00 mol PC15、0.20 mol PCl3和0.40 mol Cl2,反应达到平衡前v(正) _______v(逆)(填“>”或“=”或“<”);原因是_______。