题目内容
A、B、C、D是四种短周期元素,它们的原子序数依次增大。其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示: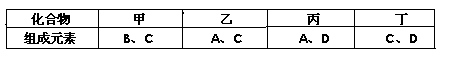
常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物。请填写下列空白:
(1)D元素形成的简单离子的结构示意图为 ,丙物质的化学式为 ,丁物质中阴离子与阳离子的个数之比为 。
(2)若标准状况下5.6L甲物质完全燃烧放出的热量为QKJ,试写出表示甲物质燃烧热的热化学方程式 。
(3)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为 。
(4)B、C两种元素按原子个数比为1:2可形成化合物戊,A、C、D三种元素按原子个数比为1:1:1可形成化合物己,则戊与己按物质的量3:4反应后溶液中溶质为 。
(5)某同学设计了一个以结构简式是BA3-CA物质为燃料的电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如下:
①写出ⅰ中通入该物质这一极的电极反应式 。
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ;在t2时所得溶液的H+ 浓度约为 。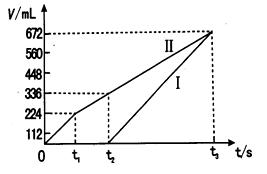
(1)NaH 1:2
(2)CO(g)+1/2O2(g)= CO2(g) ;△H=-4QkJ/mol
(3)H2O2 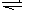 H++HO2-;(HO2-
H++HO2-;(HO2-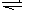 H+ +O22-可以不写第二步电离)
H+ +O22-可以不写第二步电离)
(4)Na2CO3 NaHCO3
(5)① CH3OH - 6e-+ 8OH- = CO32-+ 6H2O ② 4OH- - 4e- = O2↑+ 2H2O 0.1 mol/L
解析试题分析:根据题意可推知:A是H;B是C;C是O;D是Na;甲为:CO;乙为:H2O2;丙为:NaH;丁为Na2O2 .(1)Na的原子结构示意图为: 。丙的化学式为:NaH。Na2O2的电离方程式为:Na2O2=2Na++O22-.故阴离子与阳离子的个数之比为1:2.(2)n(CO)=V/Vm=5.6L÷22.4mol/L=0.25mol.CO燃烧热的热化学方程式为: CO(g)+1/2O2(g)= CO2(g) ;△H="-4QkJ/mol" (3)H2O2电离的方程式是:H2O2 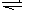 H++HO2-;HO2-
H++HO2-;HO2-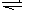 H+ +O22-(4)戊是CO2,己是NaOH.若它们按照3:4混合,则发生反应:CO2+NaOH=NaHCO3.产生3molNaHCO3,还有1molNaOH再发生反应:NaHCO3+NaOH=Na2CO3+H2O。最终得到2molNaHCO3和1molNa2CO3。(5)ⅰ是甲醇燃料电池。ⅱ是电解池。ⅰ中通入甲醇的电极是负极,电极反应式是CH3OH - 6e-+ 8OH- = CO32-+ 6H2O; 通入氧气的电极在正极。ⅱ中铁作阴极,石墨作阳极。阳极发生氧化反应,由于溶液中阴离子的还原性:Cl->OH->SO42-.所以在0—t1时间段Cl-失去电子2Cl--2e-=Cl2↑;在t1-t2时间段OH-失去电子:4OH--4e-=2H2O+O2↑阴极发生还原反应。首先是Cu2++2e-=Cu,然后是2H++2e-=H2↑.n(Cl2)=0.224L÷22.4L/mol=0.01mol.n(NaCl)=0.02mol.到t2时放出氧气:n(O2)=0.112L÷22.4L/mol=0.005mol.根据4OH--4e-=2H2O+O2↑可知消耗的n(OH-)=4×0.005mol=0.02mol.n(H+)=n(OH-)=0.02mol.所以c(H+)=n(H+)/V=0.02mol÷0.2L=0.1mol/L
H+ +O22-(4)戊是CO2,己是NaOH.若它们按照3:4混合,则发生反应:CO2+NaOH=NaHCO3.产生3molNaHCO3,还有1molNaOH再发生反应:NaHCO3+NaOH=Na2CO3+H2O。最终得到2molNaHCO3和1molNa2CO3。(5)ⅰ是甲醇燃料电池。ⅱ是电解池。ⅰ中通入甲醇的电极是负极,电极反应式是CH3OH - 6e-+ 8OH- = CO32-+ 6H2O; 通入氧气的电极在正极。ⅱ中铁作阴极,石墨作阳极。阳极发生氧化反应,由于溶液中阴离子的还原性:Cl->OH->SO42-.所以在0—t1时间段Cl-失去电子2Cl--2e-=Cl2↑;在t1-t2时间段OH-失去电子:4OH--4e-=2H2O+O2↑阴极发生还原反应。首先是Cu2++2e-=Cu,然后是2H++2e-=H2↑.n(Cl2)=0.224L÷22.4L/mol=0.01mol.n(NaCl)=0.02mol.到t2时放出氧气:n(O2)=0.112L÷22.4L/mol=0.005mol.根据4OH--4e-=2H2O+O2↑可知消耗的n(OH-)=4×0.005mol=0.02mol.n(H+)=n(OH-)=0.02mol.所以c(H+)=n(H+)/V=0.02mol÷0.2L=0.1mol/L
考点:考查元素的推断、原电池、电解池等等的知识。

β型硼氮化合物—-(BN)n是一种无机合成材料[最简式为(BN)],具有高硬度、耐高温的特点,是做超高温耐热陶瓷材料、磨料、精磨刃具的好材料。用硼砂(Na2B4O7)与尿素在高温高压下反应可以获得。例如: Na2B4O7 + 2CO(NH2)2 → 4(BN) + Na2O + 2CO2
(1)请用氧化物的形式表示硼砂的化学式 。β型(BN)n比晶体硅具有更高硬度和耐热性的原因是: 。
(21)上述反应式中具有4种不同能量电子的原子,它代表的元素在周期表中处于第 周期,第 族。
(3)能用于比较N与O非金属性相对强弱的事实是 。
| A.最高价氧化物对应水化物的酸性 | B.H2O(g) 比NH3(g)稳定 |
| C.单质与H2反应的难易程度 | D.NO中氮元素显正价,氧元素显负价 |
(5)与硼同主族且相邻周期的元素,其最高价氧化物与NaOH溶液反应的离子方程式 为: 。
A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素。
| A | |
| | C |
(1)D原子结构示意图为_____________。
(2)将C的低价态氧化物甲通入到D单质的水溶液会使之褪色,体现了甲的________性,写出该反应的离子方程式_____________________。
(3)A的最高价氧化物对应的水化物是乙,现将过量Cu加入到100 mL 8.0 mol/L乙的浓溶液中,充分反应,共收集到6.72L(标准状况)气体,则该气体的成分是_________,还原剂失电子数为_________________。
(4)将两份足量的B单质分别加入到等体积等浓度的盐酸和NaOH溶液中,充分反应生成气体的体积比为__________,若将反应后所得的溶液混合,会生成白色沉淀,发生反应的离子方程式为_____________________________________;B单质表面的氧化膜可用NaOH溶液除去,写出该反应的化学方程式___________________________________。
X、Y、Z、T是元索周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X是地壳中含量最多的元素 |
| Y | Y元素原子核外3p能级上有4个电子 |
| Z | 核素Z的质量数为14、中子数为7 |
| T | T的单质是一种常见的金属,其新制的氢氧化物悬浊液可用于检验糖尿病 |
(2) X的电负性比Y______的 (填“大”或“小”);H-X, H-Y两种共价键中,键长较长的是______(用元素符号表示,下同)。
(3) Z的最高价氧化物对应水化物的稀溶液能与单质T反应,写出该反应的化学方程式,并标出电子转移的 方向和数目: __________________。
(4) 在250C、101 kPa时,若适量的Z2和X2完全反应,每生成30 g ZX需要吸收90 kJ热量。则该反应的热化学方程式为____________。
 2EC3(g) △H<0,回答下列问题:
2EC3(g) △H<0,回答下列问题: