题目内容
20.写出下列反应的离子方程式(1)实验室制氯气
(2)氯气通入水
(3)氯气通入FeCl2溶液
(4)氯气通入NaOH溶液
(5)NO2溶于水
(6)SO2通入过量NaOH溶液
(7)Na2O2溶于水.
分析 (1)实验室用二氧化锰与浓盐酸加热反应制氯气;
(2)氯气通入水反应生成氯化氢和次氯酸;
(3)氯气通入FeCl2溶液发生氧化还原反应生成氯化铁;
(4)氯气通入NaOH溶液反应生成氯化钠、次氯酸钠和水;
(5)NO2溶于水反应生成硝酸与一氧化氮;
(6)SO2通入过量NaOH溶液反应生成亚硫酸钠和水;
(7)Na2O2溶于水反应生成氢氧化钠和氧气.
解答 解:(1)实验室制氯气离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)氯气通入水反应生成氯化氢和次氯酸,离子方程式:Cl2+H2O=H++Cl-+HClO;
故答案为:Cl2+H2O=H++Cl-+HClO;
(3)氯气通入FeCl2溶液发生氧化还原反应生成氯化铁,离子方程式:Cl2+2Fe2+=2Cl-+2Fe3+;
(4)氯气通入NaOH溶液反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-═Cl-+ClO-+H2O;
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(5)NO2溶于水反应生成硝酸与一氧化氮,离子方程式:3NO2+H2O=NO+2H++2NO3-;
故答案为:3NO2+H2O=NO+2H++2NO3-;
(6)SO2通入过量NaOH溶液反应生成亚硫酸钠和水,离子方程式:SO2+2OH-=H2O+SO32-;
故答案为:SO2+2OH-=H2O+SO32-;
(7)Na2O2溶于水反应生成氢氧化钠和氧气,离子方程式:2Na2O2+2H2O═4Na++4OH-+O2↑;
故答案为:2Na2O2+2H2O═4Na++4OH-+O2↑.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分,题目难度不大.

| A. | CaCO3+2H+=Ca2++CO2↑+H2O | B. | 2Fe2++Cl2=2Fe3++2Cl- | ||
| C. | HCO3-+H+=CO2↑+H2O | D. | Na2O+H2O=2Na++2OH- |
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3. | 溶解性 |
| 乙二醇(C2H6O2) | -11.5 | 198 | 1.11 | 与水和酒精等混溶 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 与水和酒精等混溶 |
| A. | 蒸馏法 | B. | 萃取法 | ||
| C. | “溶解、结晶、过滤”的方法 | D. | 分液法 |
| A. | 9g | B. | 18g | C. | 22g | D. | 44g |
| A. | 氯化氢 | B. | 二氧化碳 | C. | 二氧化硫 | D. | 二氧化氮 |
| A. | 加入食盐水 | B. | 加入硫酸铜溶液 | C. | 煮沸 | D. | 加入浓硝酸 |
 (1)已知热化学方程式如下:N2(g)+3H2O(1)═2NH3(g)+$\frac{3}{2}$O2(g);△H=+765.2kJ•mol-1,请在坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注.
(1)已知热化学方程式如下:N2(g)+3H2O(1)═2NH3(g)+$\frac{3}{2}$O2(g);△H=+765.2kJ•mol-1,请在坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注.
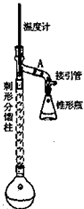 乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下:
乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下: