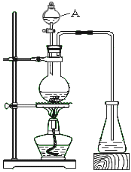
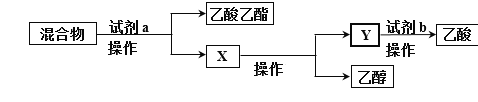
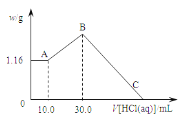
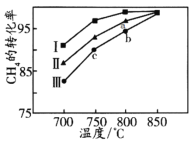
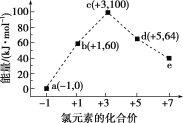
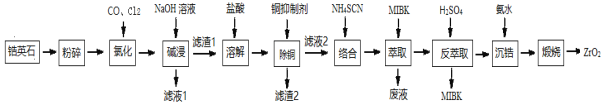
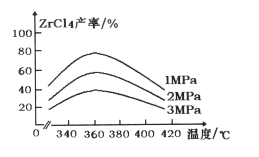
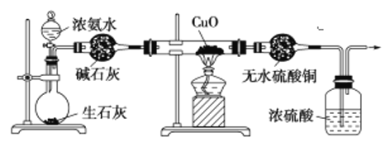
题目内容
【题目】为了避免NO、NO2、![]() 对大气的污染,常用氢氧化钠溶液进行吸收处理(反应的化学方程式:
对大气的污染,常用氢氧化钠溶液进行吸收处理(反应的化学方程式:![]() =
=![]() ;
;![]() =
=![]() )。现有由amolNO、bmolNO2、cmolN2O4 组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为( )
)。现有由amolNO、bmolNO2、cmolN2O4 组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为( )
A.![]()
B.![]()
C.![]()
D.![]()
【答案】A
【解析】
根据题干信息,先由气体分子组成关系式NO~N、NO2~N、N2O4~2N可知,混合气体所含N总的n为(a+b+2c)mol;再根据无气体剩余,设所得溶液中NaNO3、NaNO2分别为x mol、y mol,根据盐的组成关系式NaNO3~N、NaNO2~N可知,所得溶液中所含N总的n为(x+y)mol;然后根据氮原子守恒原理可知,a+b+2c=x+y;再根据盐的组成关系式NaNO3~Na、NaNO2~Na可知,所得溶液中所含Na总的n为(x+y)mol;然后根据钠元素全部来源于NaOH及其关系式NaOH~Na可知,参加反应的NaOH为(x+y)mol,亦即(a+b+2c)mol;最后由![]() 可知c(NaOH)=
可知c(NaOH)=![]() mol/L,故A选项正确;
mol/L,故A选项正确;
答案选A。

【题目】有A、B、C、D四种易溶于水的白色固体,分别由![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种阳离子和一种阴离子组成(同一种离子只存在一种物质中)。某课外小组做了以下实验:①将四种盐各取少量,分别溶于盛有一定量蒸馏水的4支试管中,只有B盐溶液呈蓝色。②分别向4支试管中加入足量稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
中的一种阳离子和一种阴离子组成(同一种离子只存在一种物质中)。某课外小组做了以下实验:①将四种盐各取少量,分别溶于盛有一定量蒸馏水的4支试管中,只有B盐溶液呈蓝色。②分别向4支试管中加入足量稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
(1)根据上述实验事实,推断盐的化学式分别为:A______;D______。
(2)写出下列反应的离子方程式:
①B+D→:______;
③C+HCl→气体:______。
(3)在作实验反思时,有同学提出:如果溶液中同时存在![]() 和
和![]() ,
,![]() 会对
会对![]() 的检验产生干扰。为了确定该溶液中是否存在
的检验产生干扰。为了确定该溶液中是否存在![]() ,该小组同学进行了如下探究实验:
,该小组同学进行了如下探究实验:
实验步骤 | 实验操作 | 实验目的 | 反应的离子方程式 |
第一步 | 向溶液中滴加过量的 | 除去 ______的干扰 | 略 |
第二步 | 向第一步实验后的溶液中滴加______ | 检验 ______的存在 | 略 |