��Ŀ����
����Ŀ�����ʻ�ѧ����й������ں��ǡ���ѧ-----���ǵ�������ǵ�δ������ѧϰ��ѧӦ�����ס���������������������ȥ������������գ�
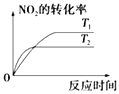
��1�����������ƵȻ��ý����Ż�ʱ��Ӧ��_______________�������
�ھ��������գ���ɫ��ӦΪdz��ɫ������ɫ�ܲ�������Ԫ���ǡ�_______________
��θ��ƽ����������������������θ����࣬�䷴Ӧ�����ӷ�Ӧ����ʽΪ��_______________��
�������ܾ�ˮ������뷽��ʽ��_______________��
��2������������DZͧ������ʱ�����Ļ�ѧ��Ӧ����ʽ��_____________��
��3������AlƬ��ʵ��������_________________��ԭ����_____________��
���𰸡� ��ɳ�� K Al(OH)3 + 3H�� ��Al3+ + 3H2O KAl(SO4)2 ��K++ Al3+ + 2SO42�� 2Na2O2 + 2CO2![]() 2Na2CO3+ O2 ��Ƭ�ڻ������Dz����� �������۵�������������������档
2Na2CO3+ O2 ��Ƭ�ڻ������Dz����� �������۵�������������������档
����������1�������Ż����ɹ������ƣ����������̼��ˮ��Ӧ����������������ˮ��Ӧ�����������������ƵȻ��ý����Ż�ʱ��Ӧ���ø�ɳ����𣻢ں�KԪ�ص�������ɫ��ӦΪdz��ɫ������ɫ�ܲ���������������������θ�ᣨ���ᣩ��������ӷ�Ӧ����ʽΪ��Al(OH)3+3H+=Al3++3H2O����������KAl(SO4)212H2O������ˮ���KAl(SO4)2��Һ������Һ������ȫ����Ϊ�����ӡ������Ӻ���������ʵ��뷽��ʽΪ��KAl(SO4)2�TK++Al3++2SO42������2������������DZͧ������ʱ�����Ļ�ѧ��Ӧ����ʽ��2Na2O2 + 2CO2![]() 2Na2CO3+ O2����3������AlƬ��ʵ����������Ƭ�ڻ������Dz����䣬ԭ�����������۵����������������������
2Na2CO3+ O2����3������AlƬ��ʵ����������Ƭ�ڻ������Dz����䣬ԭ�����������۵����������������������
�����͡������
��������
20
����Ŀ����þ�����Ļ���ﹲ0.2mol������200mL4mol��L��1��������Һ�У�Ȼ���ٵμ�2mol��L��1��NaOH��Һ����ش��������⣺
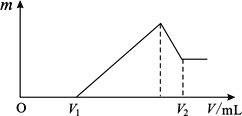
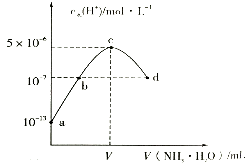
��1�����ڵμ�NaOH��Һ�Ĺ����У���������m�����NaOH��Һ�����V�仯�����ͼ��ʾ����V1=160mLʱ���������ĩ��n(Mg)=_______________mol��
��2��0~V1�η����ķ�Ӧ�����ӷ���ʽΪ_______________��
��3�����ڵμ�NaOH��Һ�Ĺ����У���ʹMg2+��Al3+ �պó�����ȫ�������NaOH��Һ�����V(NaOH)=_______________mL��
��4���Լ���V2��ֵ�� V2=_______________mL��
���𰸡� 0.12 H++OH-��H2O 400 440
�������������������0~V1��û�г������ɣ���NaOH��Һ����������ᷴӦn(HCl)=n(NaOH)=0.16L3mol/L=0.32mol,��ô��þ�����Ļ���ﷴӦ����������ʵ���Ϊ��0.2L��4mol��L��1-0.32mol=0.48mol��(1)��þ���������ʵ����ֱ�Ϊxmol��ymol�����ݣ�Mg +2 H+��Mg 2++H2��,2Al + 6H+��Al3++ 3H2��,
x 2x y 3y
���У�x+y=0.2 2x + 3y=0.48 �ã�x="0.12" mol y=0.08mol����2��0~V1����NaOH��Һ����������ᷴӦ�����ӷ���ʽΪ��H++OH-��H2O��3��Mg 2++2OH-��Mg(OH)2��, Al3++ 3 OH-��Al(OH)3��, 0.12 mol ��Mg 2+��0.08mol��Al3+�պó�����Ҫ��NaOH���ʵ���Ϊ��0.12mol��2+0.08mol��3=0.48mol���ܹ���Ҫ��NaOH�����ʵ���Ϊ��0.48mol+0.32mol=0.8mol��NaOH��Һ�����Ϊ��0.8mol��2mol��L="0.4L=400" mL��(4)��������NaOH��Һ��Al(OH)3�����ܽ⣬0.08mol��Al(OH)3�ܽ���Ҫ0.08mol��NaOH���ʵ���Ϊ��0.08mol ��Al(OH)3�պ��ܽ����ĵ�NaOH�����ʵ���Ϊ��0.8+0.08=0.88mol�����Ϊ��0.88mol��2mol��L="0.44L=440" mL��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ijʵ��С����������KMnO4��H2C2O4��Ӧͨ���ⶨ��λʱ�������� CO2������̽��Ӱ�췴Ӧ���ʵ����أ����ʵ�鷽�������
ʵ����� | A ��Һ | B ��Һ |
�� | 20 mL 0.1 molL��1 H2C2O4 ��Һ | 30 mL 0.01 molL��1KMnO4 ������Һ |
�� | 20 mL 0.2 molL��1 H2C2O4 ��Һ | 30 mL 0.01 molL��1 KMnO4������Һ |

��1��������ͼװ�������Ե����㷽��Ϊ�� ��
��2��H2C2O��Һ������ KMnO4��Һ��Ӧ�Ļ�ѧ����ʽΪ ��
��3����ʵ��̽���������ضԻ�ѧ��Ӧ���ʵ�Ӱ�죬��ͬʱ������Ͳ������CO2�������С��ϵ������ʵ����ţ���
��4����ʵ�����2minĩ�ռ���4.48mL CO2����״���£�������2minĩ��c��MnO4����=����������Һ���ǰ������ı仯����
��5��С��ͬѧ���ַ�Ӧ����������ͼ��ʾ������̽��t1��t2ʱ�������ʱ�����Ҫԭ�������������ǣ�����������K+�Ը÷�Ӧ�д����ã�