题目内容
【题目】某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如表:
实验序号 | A 溶液 | B 溶液 |
① | 20 mL 0.1 molL﹣1 H2C2O4 溶液 | 30 mL 0.01 molL﹣1KMnO4 酸性溶液 |
② | 20 mL 0.2 molL﹣1 H2C2O4 溶液 | 30 mL 0.01 molL﹣1 KMnO4酸性溶液 |

(1)检验如图装置气密性的最简便方法为: .
(2)H2C2O溶液与酸性 KMnO4溶液反应的化学方程式为 .
(3)该实验探究的是因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是(填实验序号).
(4)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)=(若忽略溶液混合前后体积的变化).
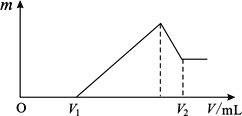
(5)小组同学发现反应速率总是如图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①、②、③K+对该反应有催化作用.
【答案】
(1)先关闭分液漏斗的活塞,再轻轻向外拉(或向内压)注射器的活塞,松手后恢复原位,表明气密性良好
(2)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(3)浓度;②>①
(4)0.0052mol/L
(5)该反应为放热反应;产物Mn2+是反应的催化剂
【解析】解:(1)检验装置气密性的简便方法为先关闭分液漏斗的活塞,再轻轻向外拉(或向内压)注射器的活塞,松手后恢复原位,表明气密性良好,故答案为:先关闭分液漏斗的活塞,再轻轻向外拉(或向内压)注射器的活塞,松手后恢复原位,表明气密性良好;(2)KMnO4和H2C2O4发生氧化还原反应生成锰离子、二氧化碳、水,KMnO4和中锰降低了5价,1个H2C2O4分子中有2个+3价的C,所以升高1×2=2价,根据化合价升降总数相等可以确定KMnO4和H2C2O4比例关系为2:5,根据电荷守恒配平方程式:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,
故答案为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O;(3)对比①②实验可探究草酸的浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,相同时间所得CO2的体积大,
故答案为:浓度;②>①;(4)CO2的物质的量为: ![]() =0.0002mol,设2min末,反应消耗的n(MnO4﹣)为x,
=0.0002mol,设2min末,反应消耗的n(MnO4﹣)为x,
2MnO4﹣+ | 5H2C2O4+ | 6H+ | = | 2Mn2++ | 10CO2↑+ | 8H2O |
2 | 10 | |||||
x | 0.0002mol |
解得 x=0.00004mol
反应剩余的高锰酸根离子的物质的量为:30×10﹣3L×0.01molL﹣1﹣0.00004mol=0.00026mol
c(MnO4﹣)= ![]() =
= ![]() =0.0052mol/L;
=0.0052mol/L;
故答案为:0.0052;(5)研究发现反应速率总是如图2所示发生变化,则t1~t2时间内速率变快的主要原因可能是:
①该反应为放热反应,反应放出的热量使环境温度升高,加快了反应速率,
②产物Mn2+是反应的催化剂,
故答案为:该反应放热;产物Mn2+是反应的催化剂.
(1)关闭分液漏斗的活塞,拉动活塞,松手后观察活塞是否复原可检查气密性;(2)KMnO4和H2C2O4发生氧化还原反应生成锰离子、二氧化碳、水,根据得失电子守恒、电荷守恒配平方程式;(3)对比①②实验可探究草酸浓度对化学反应速率的影响,②中A溶液的浓度比①中大;(4)先求出反应的n(MnO4﹣)的物质的量,再求出反应后的浓度;(5)根据反应过程中反应物浓度在减小,要加快反应的条件还可能是温度和催化剂的作用.