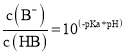题目内容
【题目】I. 雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一。已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)![]() 2NO(g) ΔH1=a kJ·mol-1
2NO(g) ΔH1=a kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g) ΔH2=b kJ·mol-1
2NO2(g) ΔH2=b kJ·mol-1
③CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH3=c kJ·mol-1
CO2(g) ΔH3=c kJ·mol-1
④2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH4
N2(g)+2CO2(g) ΔH4
(1)根据反应①②③,确定反应④中ΔH4=___________ kJ·mol-1。
II. 如图是一个化学过程的示意图,请回答下列问题:
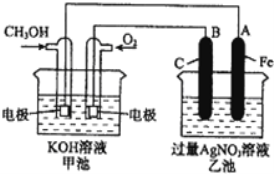
(2)请回答图中甲、乙两池的名称.乙池是_______________装置。
(3)通入甲醇的电极的电极反应式为_________________________________。
(4)乙池中反应的化学方程式为_____________________________________。
(5)电解一段时间后,乙池中A(Fe)极的质量增加5.4g时,且溶液的体积为500mL,求所得溶液在25℃时的pH=__________ ,甲池中消耗O2为 __________mL(标准状况下)。
【答案】2c-a 电解池 CH3OH - 6e﹣+ 8OH﹣ = CO32﹣ + 6H2O 4AgNO3 + 2H2O ![]() 4Ag + O2↑ + 4HNO3 1 280
4Ag + O2↑ + 4HNO3 1 280
【解析】
I.(1)利用盖斯定律计算反应④的ΔH4;
II.甲池是甲醇燃料电池,通入甲醇的电极是负极、通入氧气的电极是正极;乙池是电解池,电极B与正极相连,B是阳极,电极A与负极相连,A是阴极。
(1)①N2(g)+O2(g)![]() 2NO(g) ΔH1=a kJ·mol-1
2NO(g) ΔH1=a kJ·mol-1
③CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH3=c kJ·mol-1
CO2(g) ΔH3=c kJ·mol-1
根据盖斯定律,③×2-①得④2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH4=2c-a;
N2(g)+2CO2(g) ΔH4=2c-a;
(2)乙池与燃料电池甲相连,乙池是电解装置。
(3)甲池是甲醇燃料电池,通入甲醇的电极是负极,甲醇失电子生成碳酸钾,电极反应式为CH3OH - 6e﹣+ 8OH﹣ = CO32﹣ + 6H2O。
(4)乙池是电解池,用惰性电极电解硝酸银溶液,反应的化学方程式为4AgNO3 + 2H2O ![]() 4Ag + O2↑ + 4HNO3。
4Ag + O2↑ + 4HNO3。
(5)电解一段时间后,乙池中A(Fe)极的质量增加5.4g,即生成5.4g Ag,Ag的物质的量是![]() ,电路中转移0.05mol电子,根据
,电路中转移0.05mol电子,根据![]() ,乙池生成硝酸的物质的量是0.05mol,乙池溶液的体积为500mL,氢离子浓度为0.1mol/L,在25℃时的pH=1,甲池中消耗O2为
,乙池生成硝酸的物质的量是0.05mol,乙池溶液的体积为500mL,氢离子浓度为0.1mol/L,在25℃时的pH=1,甲池中消耗O2为![]() 280mL(标准状况下)。
280mL(标准状况下)。