题目内容
2.浓硫酸是一种重要的化工产品.某化学兴趣小组拟探究Cu与浓H2SO4的反应.Ⅰ.[查阅资料]
铜与浓硫酸反应产生黑色物质的相关性质资料如下表:
| 资料1 | 硫酸浓度mol/L | 黑色物质出现的温度∕℃ | 黑色物质消失的温度∕℃ |
| 15 | 约150 | 约236 | |
| 16 | 约140 | 约250 | |
| 18 | 约120 | 不消失 | |
| 资料2 | X射线衍射晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种. | ||

(1)试管A中发生的反应的主要化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(2)反应进行一段时间可观察到试管B中的现象为溶液由红色变成无色.
(3)试管C浸有NaOH溶液的棉团与试管E的NaOH溶液的作用是否相同相同(填“相同或不相同”)
(4)如同时将试管B换成试管D,将试管C换成试管E,并从试管D的直立导管中通入另一种气体,试管D中产生白色沉淀,则气体可以是NH3(NO2或ClO2)、Cl2(O3或O2或Br2蒸汽)(填一种化合物和一种单质的化学式);试管E中CCl4的作用是防倒吸.
(5)用简单方法证明A试管中反应所得产物含有铜离子的操作方法是(停止反应,冷却后),取A中溶液少许于一盛有少量水的烧杯(试管)里,摇匀,观察溶液颜色呈蓝色;分离出试管E中的上层液体,其分离的操作名称为分液.
Ⅲ.[问题反思]
(6)仅由上述资料及探究过程可得出的正确结论是abd.
a.铜与浓硫酸作用所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免产物中出现黑色物质
c.反应发生条件之一是硫酸浓度≥15mol/L
d.硫酸浓度越大,黑色物质越快出现,越难消失.
分析 (1)碳可以和浓硫酸反应生成二氧化碳、二氧化硫以及水,据此写出反应的化学方程式;
(2)二氧化硫检验漂白性,能够使品红溶液褪色;
(3)二氧化硫有毒,需要用氢氧化钠溶液吸收,两个装置中都是为了吸收多余的二氧化硫;
(4)二氧化硫不与氯化钡溶液反应,通入的气体需要满足把二氧化硫转化为盐或把二氧化硫氧化为硫酸;二氧化硫不溶于四氯化碳,起到了防止倒吸达到作用;
(5)证明A试管中反应所得产物是否含有铜离子的操作方法是利用铜离子在溶液中呈蓝色;分离不溶的液体通常使用分液操作;
(6)图表数据分析铜和浓硫酸反应过程中会生成黑色物质证明有副反应,浓度合适会避免黑色固体出现,浓度越大,温度越高黑色越难消失.
解答 解:(1)碳可以和浓硫酸反应生成二氧化碳、二氧化硫和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)反应中有二氧化硫生成,二氧化硫检验漂白性,所以装置B中品红溶液会褪色,
故答案为:溶液由红色变成无色;
(3)试管C浸有NaOH溶液的棉团与试管E的NaOH溶液的作用都是吸收多余的二氧化硫,所以两个装置的作用相同,
故答案为:相同;
(4)将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,是因为二氧化硫不与氯化钡溶液反应,通入的气体需要满足把二氧化硫转化为盐或把二氧化硫氧化为硫酸,如碱性气体NH3、做氧化剂的气体如Cl2、O2、O3、Br2、NO2、NO、ClO2、Cl2O等,要求填二种化合物和二种单质的化学式,可以是NH3(NO2或ClO2 ); Cl2(O3或O2或Br2蒸汽);
二氧化硫直接与氢氧化钠溶液反应,容易发生倒吸现象,而二氧化硫不溶于四氯化碳,可以防止倒吸,
故答案为:NH3(NO2 或ClO2 ); Cl2(O3或O2或Br2蒸汽);防倒吸;
(5)可通过抽动铜丝控制反应,证明A试管中反应所得产物是否含有铜离子的操作方法是利用铜离子在溶液中呈蓝色,向上拉铜丝,终止反应,冷却后,将A中溶液慢慢倒入盛有少量水的烧杯(试管)里,观察溶液颜色是否为蓝色证明是否生成铜离子;
氢氧化钠溶液与四氯化碳不相容,可以通过分液操作将混合物分离,
故答案为:(停止反应,冷却后),取A中溶液少许于一盛有少量水的烧杯(试管)里,摇匀,观察溶液颜色呈蓝色;分液;
(6)依据图表数据分析可知,浓度不同时出现黑色物质的时间随浓度增大减小,浓度为18mol/L时生成的黑色物质不能消失;
a.分析过程可知.发生的反应过程中生成二氧化硫和硫酸铜的反应过程中有奇谈反应发生生成黑色物质,铜与浓硫酸反应时所涉及的反应可能不止一个,故a正确;
b.图表数据分析可知硫酸浓度选择适当,可避免最后产物中出现黑色物质,故b正确;
c.浓硫酸和铜的反应浓度小于15mol/L也可能出现黑色物质,出现的时间长,该反应发生的条件不一定是硫酸浓度≥15mol•L-1,故c错误;
d.图表数据中,18mol/L的浓硫酸,出现褐色物质的时间短,黑色物质难以消失,所以硫酸浓度越大,黑色物质越快出现、越难消失,故d正确;
故答案为:abd.
点评 本题考查了物质性质实验方案的设计,题目难度中等,试题侧重于浓硫酸与铜反应,注意掌握二氧化硫的漂白性、氧化性的实验验证、污染气体的实验处理方法,试题培养了学生的分析、归纳能力及化学实验能力.

 名校课堂系列答案
名校课堂系列答案| A. | 保持温度不变,缩小容器的体积,平衡向逆反应方向移动,再次达到平衡时气体的颜色变浅了 | |
| B. | 若保持恒温恒压,再充入一定量的NO2气体,当容器的体积不再变化时表明重新达到平衡状态 | |
| C. | 保持容器的体积不变,升高温度,正反应速率加快,逆反应速率减慢,平衡向正反应方向移动 | |
| D. | 恒温恒容条件下,再充入一定量的N2O4,达到新平衡时NO2的体积分数比原平衡的大 |
| A. | NH5的熔沸点低于N3的熔沸点 | |
| B. | NH5中N元素显+5价 | |
| C. | NH5固体投人稀盐酸中,会生成氨气和氩气 | |
| D. | NH5中滴人少量的水时会剧烈反应,该反应的化学方程式可表示为山NH5═NH3↑+H2↑ |
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 当v逆(X)=2v正(Z),可以说明反应达平衡 | |
| B. | 反应前2 min的平均速率v(Z)=4.0×10?3 mol•L?1•min?1 | |
| C. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大 | |
| D. | 该反应在350℃时的平衡常数小于1.44 |
| A. | 卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来 | |
| B. | 卤族元素从C1到I,最高价氧化物对应水化物的酸性减弱 | |
| C. | 卤族元素从F到I,HX水溶液酸性增强 | |
| D. | 卤素单质从F2到I2颜色加深,熔沸点升高 |
| A. | CO2、Cl2、N2、酸雨 | B. | SO2、CO、NO2、烟尘 | C. | NH3、CO、NO2、雾 | D. | SO2、HCl、N2、粉尘 |
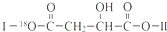 (其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.
(其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.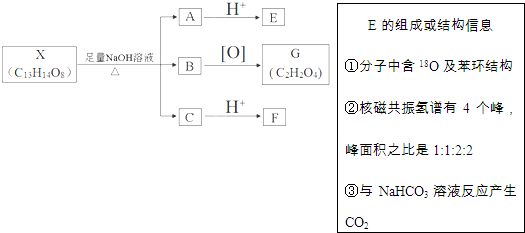
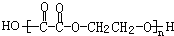 +(2n-1)H2O
+(2n-1)H2O +4NaOH$→_{△}^{水}$
+4NaOH$→_{△}^{水}$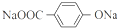 +NaOOCCH2CH(OH)COOONa+HOCH2CH2OH+2H2O
+NaOOCCH2CH(OH)COOONa+HOCH2CH2OH+2H2O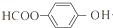 等
等 -
- ;反应类型:取代反应
;反应类型:取代反应 ;反应类型:加聚反应
;反应类型:加聚反应