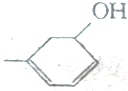
题目内容
7.300℃时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:下列说法正确的是( )| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 当v逆(X)=2v正(Z),可以说明反应达平衡 | |
| B. | 反应前2 min的平均速率v(Z)=4.0×10?3 mol•L?1•min?1 | |
| C. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大 | |
| D. | 该反应在350℃时的平衡常数小于1.44 |
分析 A.不同物质表示的正逆速率之比等于其化学计量数之比,可逆反应到达平衡;
B.根据v=$\frac{△c}{△t}$计算2min内Y表示的反应速率,再利用速率之比等于化学计量数之比计算v(Z);
C.其他条件不变,再充入0.2 mol Z,等效为压强增大到达的平衡,反应前后气体体积不变,增大压强平衡不移动;
D.由表中数据可知,7min与9min时Y的物质的量相等,说明7min时到达平衡,利用三段式计算平衡时各组分物质的量,由于反应气体体积不变,用物质的量代替浓度代入平衡常数表达式K=$\frac{{c}^{2}(Z)}{c(X)×c(Y)}$,计算300℃时平衡常数,该反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小.
解答 解:A.当v逆(X)=2v正(Z),则v逆(X):v正(Z)=2:1,不等于其化学计量数之比1:2,故A错误;
B.由表中数据可知,2min内参加反应的Y为0.16mol-0.12mol=0.04mol,则v(Y)=$\frac{\frac{0.04mol}{10L}}{2min}$=2.0×10?3 mol•L?1•min?1,速率之比等于化学计量数之比,v(Z)=2v(Y)=4.0×10?3 mol•L?1•min?1,故B正确;
C.其他条件不变,再充入0.2 mol Z,等效为压强增大到达的平衡,反应前后气体体积不变,增大压强平衡不移动,平衡时X的体积分数不变,故C错误;
D.由表中数据可知,7min与9min时Y的物质的量相等,说明7min时到达平衡,
X(g)+Y(g)?2Z(g)
开始(mol):0.16 0.16 0
转化(mol):0.06 0.06 0.12
平衡(mol):0.1 0.1 0.12
由于反应气体体积不变,用物质的量代替浓度计算平衡常数,故300℃时平衡常数K=$\frac{{c}^{2}(Z)}{c(X)×c(Y)}$=$\frac{0.1{2}^{2}}{0.1×0.1}$=1.44,该反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,即该反应在350℃时的平衡常数小于1.44,故D正确,
故选:BD.
点评 本题考查化学反应速率计算、化学平衡计算、等效平衡、化学平衡常数计算及影响因素等,C选项注意利用等效平衡分析解答,也可以利用借助平衡常数理解,难度中等.

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案| A. | 溴苯中混有溴,加入KI溶液,用汽油萃取出溴 | |
| B. | 乙烷中混有乙烯,在一定条件下反应通入氢气,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有浓硝酸和浓硫酸,将其倒入浓烧碱溶液中,静置,然后分液 | |
| D. | 乙烷中混有CO2,将其通入碳酸氢钠溶液洗气后干燥 |

| A. | pH=2、温度为50℃、10 min时,X的物质的量浓度c( X)为5.6×10-4mol•L-1 | |
| B. | 图2说明:任何条件下X降解率均随温度升高先增后减 | |
| C. | 无需再进行后续实验,就可以判断最佳反应条件是:pH=3、温度为80℃ | |
| D. | 图1说明:50℃时,X的降解率随溶液PH的增大而逐渐减小 |
Ⅰ.[查阅资料]
铜与浓硫酸反应产生黑色物质的相关性质资料如下表:
| 资料1 | 硫酸浓度mol/L | 黑色物质出现的温度∕℃ | 黑色物质消失的温度∕℃ |
| 15 | 约150 | 约236 | |
| 16 | 约140 | 约250 | |
| 18 | 约120 | 不消失 | |
| 资料2 | X射线衍射晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种. | ||

(1)试管A中发生的反应的主要化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(2)反应进行一段时间可观察到试管B中的现象为溶液由红色变成无色.
(3)试管C浸有NaOH溶液的棉团与试管E的NaOH溶液的作用是否相同相同(填“相同或不相同”)
(4)如同时将试管B换成试管D,将试管C换成试管E,并从试管D的直立导管中通入另一种气体,试管D中产生白色沉淀,则气体可以是NH3(NO2或ClO2)、Cl2(O3或O2或Br2蒸汽)(填一种化合物和一种单质的化学式);试管E中CCl4的作用是防倒吸.
(5)用简单方法证明A试管中反应所得产物含有铜离子的操作方法是(停止反应,冷却后),取A中溶液少许于一盛有少量水的烧杯(试管)里,摇匀,观察溶液颜色呈蓝色;分离出试管E中的上层液体,其分离的操作名称为分液.
Ⅲ.[问题反思]
(6)仅由上述资料及探究过程可得出的正确结论是abd.
a.铜与浓硫酸作用所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免产物中出现黑色物质
c.反应发生条件之一是硫酸浓度≥15mol/L
d.硫酸浓度越大,黑色物质越快出现,越难消失.
| A. | ${\;}_{2}^{3}$He代表原子核内有2个质子和3个中子的氦原子 | |
| B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He分别含有1和2个质子 | |
| C. | ${\;}_{2}^{3}$He 和${\;}_{2}^{4}$He互为同位素 | |
| D. | ${\;}_{2}^{3}$He的最外层电子数为1,所以${\;}_{2}^{3}$He 具有较强的金属性 |
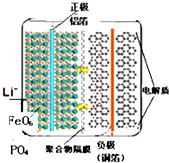
| A. | 放电时,铝箔所在电极为负极,铜箔所在电极为正极 | |
| B. | 放电时,电池反应式为:FePO4+Li═LiFePO4 | |
| C. | 充电时,Li+向阴极移动 | |
| D. | 充电时,阳极的电极反应式为:LiFePO4-e-═FePO4+Li+ |
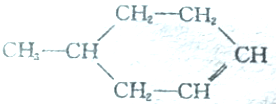 可以写成
可以写成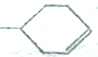 ,现有有机物A,可写为
,现有有机物A,可写为