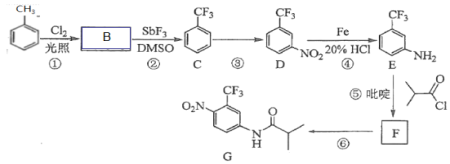
题目内容
【题目】任何物质的水溶液都存在水的电离平衡,其电离方程式可表示为:H2OH++OH-。请回答下列有关问题:
(1)现欲使水的电离平衡向右移动,且所得溶液呈酸性,可以选择的方法有_________。
A.加热至100℃ B.加入 NaHSO4(s) C.加入CH3COONa(s) D.加入NH4Cl(s)
(2)在t℃时,测得0.01mol·L-1的NaOH溶液的pH=11,则该温度下水的离子积为_____,此温度____25℃(选填“大于”“小于”或“等于”),理由是________。
(3)在25℃时,将pH=a的NaOH溶液VaL与pH=b的HCl溶液VbL混合,请填写下列空白:
①若所得溶液呈中性,且a=11,b=3,则Va:Vb=__________。
②若所得溶液呈中性,且Va:Vb=10:1,则a+b=__________。
③若所得混合溶液的pH=10,且a=12,b=2,则 Va: Vb=___________。
④若将pH=12的NaOH溶液VaL与VbL水混合后所得溶液的pH=10,则Va:Vb=____。
【答案】D 10-13 大于 在0.01mol·L-1的NaOH溶液的pH=11可知c(H+)=1×10-11mol·L-1,c(OH-)=10-2 mol·L-1,则Kw=c(H+)·c(OH-)=10-13>10-14,说明t℃时水的离子积大于25℃时水的离子积,说明条件改变,促进了水的电离,根据平衡移动原理,t℃大于25℃ 1:10 12 1:9 1:99
【解析】
(1)使水的电离平衡向右移动的方法有升高温度、加入强酸弱碱盐或强碱弱酸盐等,如果溶液呈酸性,说明溶液中氢离子浓度大于氢氧根离子浓度;
(2)0.01mol/L的NaOH溶液的pH为11,则c(H+)=1×10-11mol/L,c(OH-)=0.01mol/L,根据Kw=c(H+)c(OH-)计算;依据25℃Kw=c(H+)c(OH-)=10-14判断t℃的大小;
(3) t℃时,pH=a的NaOH溶液VaL,溶液中n(OH-)=10a-13·Va,pH=b的HCl溶液VbL,溶液中n(H+)=10-b·Vb。
(1) A.加热至100℃,促进水的电离,溶液仍呈中性,故A错误;
B.向水中加入NaHSO4固体,电离出的氢离子抑制水的电离,故B错误;
C.向水中加CH3COONa,水解呈碱性,故C错误;
D.向水中加入NH4Cl固体,水解呈酸性,故D正确;
D正确,故答案为:D;
(2)由0.01mol·L-1的NaOH溶液的pH=11可知,溶液中c(H+)=1×10-11mol·L-1,c(OH-)=10-2 mol·L-1,则Kw=c(H+)·c(OH-)=10-13>10-14,说明t℃时水的离子积大于25℃时水的离子积,说明条件改变,促进了水的电离,根据平衡移动原理可知,t℃大于25℃,故答案为:在0.01mol·L-1的NaOH溶液的pH=11可知c(H+)=1×10-11mol·L-1,c(OH-)=10-2 mol·L-1,则Kw=c(H+)·c(OH-)=10-13>10-14,说明t℃时水的离子积大于25℃时水的离子积,说明条件改变,促进了水的电离,根据平衡移动原理,t℃大于25℃;
(3) t℃时,pH=a的NaOH溶液VaL,溶液中n(OH-)=10a-13·Va,pH=b的HCl溶液VbL,溶液中n(H+)=10-b·Vb;
①由溶液呈中性可得10a-13Va=10-bVb,解得Va:Vb=1013-(a+b)=10:1,故答案为:10:1;
②由溶液呈中性可得由溶液呈中性可得10a-13Va=10-bVb,若Va:Vb=10:1,解得a+b=12,故答案为:12;
③若所得混合溶液的pH=10,则溶液中c(OH-)=![]() =10-3,由a=12和b=2可得Va:Vb=1:9,故答案为:1:9;
=10-3,由a=12和b=2可得Va:Vb=1:9,故答案为:1:9;
④由pH=12的NaOH溶液VaL与VbL水混合后所得溶液的pH=10可得溶液中c(OH-)=![]() =10-3,解得Va:Vb=1:99,故答案为:1:99。
=10-3,解得Va:Vb=1:99,故答案为:1:99。