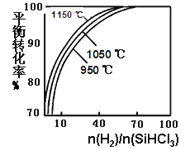
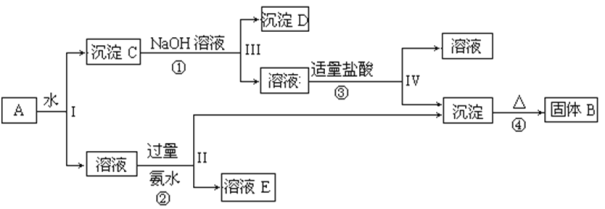
题目内容
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,![]() 比
比![]() 少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为
少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为![]() ,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中
,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中![]() 与
与![]() 离子数之比为2:1。请回答下列问题:
离子数之比为2:1。请回答下列问题:
(1)![]() 形成的晶体属于______
形成的晶体属于______![]() 填写离子、分子、原子
填写离子、分子、原子![]() 晶体.
晶体.
(2)![]() 的电子排布式为______,在
的电子排布式为______,在![]() 分子中C元素原子的原子轨道发生的是______杂化,
分子中C元素原子的原子轨道发生的是______杂化,![]() 分子的VSEPR模型为______.
分子的VSEPR模型为______.
(3)![]() 的氢化物在水中的溶解度特别大,原因______
的氢化物在水中的溶解度特别大,原因______
(4)![]() 元素与同周期相邻元素的第一电离能由大到小的关系是:______
元素与同周期相邻元素的第一电离能由大到小的关系是:______![]() 用元素符号表示
用元素符号表示![]() ;用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:______.
;用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:______.
(5)已知下列数据:
![]()
![]()
由![]() 和
和![]() 反应生成CuO的热化学方程式是______.
反应生成CuO的热化学方程式是______.
【答案】离子 ![]()
![]() 四面体形 氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,氨气极易溶于水
四面体形 氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,氨气极易溶于水 ![]()
![]()
![]()
【解析】
B原子得一个电子填入3p轨道后,3p轨道已充满,B为Cl元素;![]() 比
比![]() 少一个电子层,则A为Na;C原子的p轨道中有3个未成对电子,C原子的外围电子排布为
少一个电子层,则A为Na;C原子的p轨道中有3个未成对电子,C原子的外围电子排布为![]() ,是第VA族元素,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,所以为N元素;D的最高化合价和最低化合价的代数和为4,为第VIA族元素,最高价氧化物中含D的质量分数为
,是第VA族元素,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,所以为N元素;D的最高化合价和最低化合价的代数和为4,为第VIA族元素,最高价氧化物中含D的质量分数为![]() ,可推知D的相对原子质量为32,其核内质子数等于中子数,所以质子数为16,D为S元素;
,可推知D的相对原子质量为32,其核内质子数等于中子数,所以质子数为16,D为S元素;![]() 是
是![]() 离子,
离子,![]() 离子是
离子是![]() 离子,R是由
离子,R是由![]() 离子与
离子与![]() 离子以2:1形成的离子化合物,R是硫化钠,以此解答本题。
离子以2:1形成的离子化合物,R是硫化钠,以此解答本题。
(1)由上述分析可知:R是硫化钠,是由A、D两元素形成的离子化合物,属于离子晶体,故答案为:离子;
(2)由C为N元素,![]() 核外有10个电子,根据构造原理知,该离子基态核外电子排布式为:
核外有10个电子,根据构造原理知,该离子基态核外电子排布式为:![]() ,
,![]() 分子为
分子为![]() 分子,N原子有一对孤对电子,与Cl原子成3个
分子,N原子有一对孤对电子,与Cl原子成3个![]() 键,N原子发生
键,N原子发生![]() 杂化,所以
杂化,所以![]() 分的VSEPR模型为四面体形, 故答案为:
分的VSEPR模型为四面体形, 故答案为:![]() ;
;![]() ;四面体形;
;四面体形;
![]() 氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,氨气极易溶于水;故答案为:氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,氨气极易溶于水;
氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,氨气极易溶于水;故答案为:氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,氨气极易溶于水;
![]() 同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,所以P、S、Cl元素的第一电离能大小顺序是:
同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,所以P、S、Cl元素的第一电离能大小顺序是:![]() ;
;
同一周期元素中,元素的电负性随着原子序数的增大而增大,一般来说电负性越强,元素的非金属性越强,对应的单质的氧化性越强,如在![]() 反应中,
反应中,![]() 的氧化性大于
的氧化性大于![]() 的氧化性, 故答案为:
的氧化性, 故答案为:![]() ;
;![]() ;
;
![]() 已知:
已知:![]()
![]()
根据盖斯定律,![]() 得:
得:![]() ,
,
故答案为:![]() .
.