题目内容
【题目】工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2) 2],反应的化学方程式为 2NH3(g)+ CO2 (g) CO(NH2) 2(l)+ H2O(l)+Q(Q>0)。该反应分两步进行:① 2NH3(g)+ CO2 (g) NH4COONH2 (s)+ Q1(Q1>0),② NH4COONH2 (s) CO(NH2) 2(l)+ H2O(l)+Q2 (Q2<0).
(1)固体CO2称干冰,属于___________晶体。氮原子最外层电子排布式是___________。
(2)氧元素的非金属性比碳强,用原子结构的知识说明理由_________________
(3)下列示意图中,能正确表示合成尿素过程中能量变化的是____________。
A、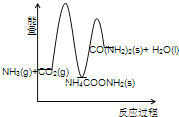 B、
B、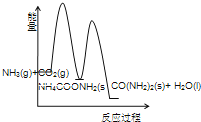
C、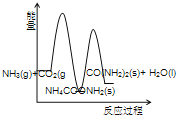 D、
D、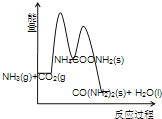
(4)写出合成尿素第一步反应的平衡常数表达式K=_________________________________。
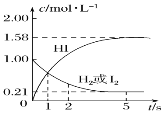
(5)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如图所示。
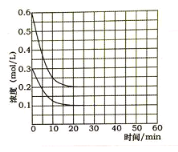
① 在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为___________。
② 为提高合成尿素的产率,下列可以采取的措施有____________。
a. 缩小反应容器的容积 b. 升高温度
c. 增加反应物的量 d. 使用合适的催化剂
③ 若保持平衡的温度和体积不变,25min 时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在下图中画出25~50min内氨气的浓度变化曲线____________。
【答案】分子 2s22p3 氧元素和碳元素同周期,电子层数相同,氧元素的核电荷数比碳元素多,吸引电子能力强,因此非金属性比碳强 C 1/[c2(NH3)c(CO2)] 0.01 mol/(L·min) a 
【解析】
(1)干冰,属于熔、沸点较低的分子晶体;氮原子原子序数为7,位于周期表第二周期ⅤA族;
(2)同周期元素从左到右,随着核电荷数递增,原子半径减小,吸引电子能力依次增强,非金属性依次增;
(3)根据反应物和生成物的能量高低与反应吸放热之间的关系来判断;
(4)依据化学平衡常数表达式=生成物平衡浓度系数次幂的乘积反应物平衡浓度系数次幂的乘积来书写;
(5)由氨气和二氧化碳的物质的量比为2:1,结合各物质浓度的变化曲线可知,起始时c(NH3)和c(CO2)分别为0.6mol/L和0.3mol/L,平衡时c(NH3)和c(CO2)分别为0.2mol/L和0.1mol/L。
①根据化学反应速率等于单位时间内物质浓度的变化量来计算;
②根据影响化学平衡移动的因素来回答判断;
③根据等效平衡知识来作图。
(1)固体CO2称干冰,属于熔、沸点较低的分子晶体;氮原子原子序数为7,位于周期表第二周期ⅤA族,最外层电子排布式是2s22p3,故答案为:分子;2s22p3;
(2)氧元素和碳元素均为第二周期元素,同周期元素从左到右,随着核电荷数递增,原子半径减小,吸引电子能力依次增强,非金属性依次增强,故答案为:氧元素和碳元素同周期,电子层数相同,氧元素的核电荷数比碳元素多,吸引电子能力强,因此非金属性比碳强;
(3)由题意可知,合成尿素的反应和反应①为放热反应,反应物的总能量高于生成物的总能量;反应②为吸热反应,反应物的总能量低于生成物的总能量。
A、合成尿素的反应为放热反应,2NH3(g)+ CO2 (g) 的总能量高于 CO(NH2)2(l)+H2O(l)的总能量,故错误;
B、反应②为吸热反应,NH4COONH2 (s) 的总能量低于 CO(NH2)2(l)+H2O(l)的总能量,故错误;
C、合成尿素的反应和反应①为放热反应,反应②为吸热反应,则2NH3(g)+ CO2 (g) 的总能量高于 CO(NH2)2(l)+H2O(l)的总能量,NH4COONH2 (s) 的总能量低于 CO(NH2)2(l)+H2O(l)的总能量,故正确;
D、合成尿素的反应为放热反应,2NH3(g)+ CO2 (g) 的总能量高于 CO(NH2)2(l)+H2O(l)的总能量,故错误;
故选C,故答案为:C;
(4)反应①中为NH4COONH2固体,则化学平衡常数K=1/[c2(NH3)c(CO2)],故答案为:1/[c2(NH3)c(CO2)];
(5)①从反应开始至20min时,二氧化碳浓度变化量△c(CO2)=(0.3mol/L—0.1mol/L)=0.2mol/L,则v c(CO2)= △c(CO2)/ △t=0.2mol/L/20min=0.01 mol/(L·min),故答案为:0.01 mol/(L·min);
②该反应为气体体积减小的放热反应,缩小反应容器的容积,压强增大,平衡右移,尿素的产率增大;升高温度,平衡左移,尿素的产率减小;增加反应物的量,平衡右移,但尿素的产率不一定增大;使用合适的催化剂,平衡不移动,尿素的产率不变,故选a,故答案为:a;
③25min 时再向容器中充入2mol氨气和1mol二氧化碳,体系中c(NH3)和c(CO2)分别变为0.4mol/L和0.2mol/L,40min时重新达到平衡,由于建立的是等效平衡,氨气的平衡浓度保持不变,故图示为: ,故答案为:
,故答案为: 。
。

【题目】钼酸钠晶体(Na2MoO4·2H2O)可抑制金属腐蚀。以钼精矿(主要成分为MoS2,含少量杂质)为原料,制备钼酸钠晶体的主要流程图如下图。
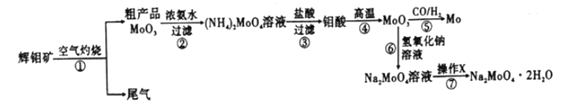
回答下列问题
(1)完成下列反应:_____MoS2+ _____O2![]() _____SO2+ _____MoO3
_____SO2+ _____MoO3
在焙烧炉中,空气从炉底进入矿石经粉碎后从炉顶进入,这样处理的目的是_____________。
(2)浓氨水浸取粗产品获得(NH4)2MoO4溶液,其化学反应方程式为___________;该反应说明MoO3______(填“有”或“没有”)酸性氧化物的性质。
(3)常温下,沉钼阶段所得废液为(NH4)2SO4稀溶液。若(NH4)2SO4稀溶液的pH=a,则![]() =_______(用含a的代数式表示,NH3·H2O的Kb=1.8×10-5),若将此稀溶液蒸发浓缩,
=_______(用含a的代数式表示,NH3·H2O的Kb=1.8×10-5),若将此稀溶液蒸发浓缩,![]() 将_________(填“变大”“不变”或“变小”)。
将_________(填“变大”“不变”或“变小”)。
(4)操作X为_________________ ,已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,则在操作X中应控制温度的最佳范围为________________。
温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O | Na2MoO4 | ||||||
溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 |
| |
结晶得到的母液可以在下次结晶时重复使用,但达到一定次数后必须净化处理,原因是___。
(5)Li、MoS2 可充电电池的工作原理为![]() [Lix(MOS2)n附着在电极上],则电池充电时阳极的电极反应式为_________________________ 。
[Lix(MOS2)n附着在电极上],则电池充电时阳极的电极反应式为_________________________ 。