题目内容
18.下图是苯和溴的取代反应的实验装置图,其中A为具有支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量的铁屑粉,填写下列空白: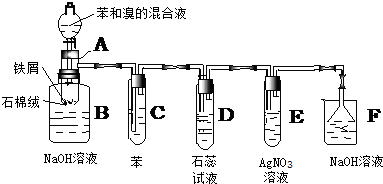
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应,写出A中发生反应的化学方程式(有机物写结构简式)2Fe+3Br2=2FeBr3,

(2)试管C中苯的作用是除去HBr气体中混有的溴蒸气,反应开始后,观察D和E两试管,D中看到的现象是石蕊试液慢慢变红,并在导管口有白雾产生,E中看到的现象是有白雾,产生淡黄色沉淀.
(3)反应2min~3min后,在B中的氢氧化钠溶液里可观察到的现象是溶液中有红褐色的絮状物生成,底部有无色油状物质生成,液面上有白雾
(4)在上述整套装置中,具有防倒吸作用的仪器有DEF(填字母).
(5)改进后的实验除:①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是:充分吸收有毒气体,防止大气污染
(6)将B中的产物进行过滤,将滤液转移到分液漏斗中分液,将下层液体再次水洗分液而后进行干燥,最后得到的液体中主要含有的有机物苯和溴苯.
分析 (1)Fe与溴反应生成溴化铁,苯和液溴在溴化铁作催化剂条件下能发生取代反应生成溴苯与HBr;
(2)溴苯中的溴易挥发,非极性分子的溶质易溶于非极性分子的溶剂,据此分析苯的作用;该反应中有溴化氢生成,溴化氢溶于水得到氢溴酸,氢溴酸能使石蕊试液变红色;氢溴酸能和硝酸银反应生成淡黄色沉淀溴化银;
(3)溴化铁与氢氧化钠反应生成氢氧化铁沉淀,氢氧化钠除去为反应的溴,溴苯与氢氧化钠溶液不互溶;
(4)HBr易溶于水,直接将导管伸入水溶液液面以下,会发生倒吸;
(5)本实验中进行尾气处理,防止污染空气;
(6)本实验中涉及的有机物主要是苯和溴苯,将B中的产物进行过滤,将滤液转移到分液漏斗中分液,将下层液体再次水洗分液而后进行干燥,最后得到的液体中主要含有的有机物就是苯和溴苯;
解答 解:(1)Fe与溴反应生成溴化铁,苯和液溴在溴化铁作催化剂条件下能发生取代反应生成溴苯与HBr,反应方程式为:2Fe+3Br2=2FeBr3, ,
,
故答案为:2Fe+3Br2=2FeBr3, ;
;
(2)溴苯中的溴易挥发,溴和四氯化碳都是非极性分子,根据相似相溶原理知,溴易溶于四氯化碳,所以四氯化碳的作用是吸收溴蒸汽;该反应中有溴化氢生成,溴化氢溶于水得到氢溴酸,氢溴酸是酸性物质,能使石蕊试液变红色;氢溴酸能和硝酸银反应生成淡黄色沉淀溴化银,所以观察D和E两试管,看到的现象是D管中变红,E管中出现有白雾,产生淡黄色沉淀,
故答案为:除去HBr气体中混有的溴蒸气;石蕊试液慢慢变红,并在导管口有白雾产生;有白雾,产生淡黄色沉淀;
(3)苯与液溴发生取代反应生成溴苯和溴化氢,溴苯是密度大于水,无色的油状液体,溴化氢易挥发,能与水蒸气结合成氢溴酸液滴,溴化铁与氢氧化钠反应生成红褐色的氢氧化铁沉淀,
故答案为:溶液中有红褐色的絮状物生成,底部有无色油状物质生成,液面上有白雾;
(4)HBr易溶于水,直接将导管伸入水溶液液面以下,会发生倒吸,装置D、E中导管口在液面上方,能防止倒吸,F中倒置漏斗增大了气体与氢氧化钠溶液的接触面积,有缓冲作用,能够防止倒吸,
故答案为:DEF;
(5)本实验中进行尾气处理,充分吸收有毒气体,防止大气污染,
故答案为:充分吸收有毒气体,防止大气污染;
(6)本实验中涉及的有机物主要是苯和溴苯,将B中的产物进行过滤,将滤液转移到分液漏斗中分液,将下层液体再次水洗分液而后进行干燥,最后得到的液体中主要含有的有机物就是苯和溴苯,
故答案为:苯和溴苯.
点评 本题考查了苯的取代反应实验,考查的知识点有反应方程式的书写、产物的判断、蒸汽的成分及性质,有一定的综合性,难度中等,注意苯能和液溴发生取代反应,和溴水不反应.

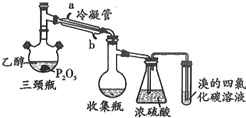 有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验.按如表所示的量和反应条件在三颈瓶中加入一定量P2O5,再注入95%的乙醇,并加热,观察现象.
有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验.按如表所示的量和反应条件在三颈瓶中加入一定量P2O5,再注入95%的乙醇,并加热,观察现象.| 实验 | P2O5/g | 95%乙醇量/mL | 加热方式 |
| 实验1 | 2 | 4 | 酒精灯 |
| 实验2 | 2 | 4 | 水浴70℃ |
| 实验 | 实验现象 | ||
| 三颈瓶 | 收集瓶 | 试管 | |
| 实验1 | 酒精加入时,立刻产生白雾,当用酒精灯加热时,有气泡产生,并逐渐沸腾,生成黏稠状液体 | 有无色液体 | 溶液褪色 |
| 实验2 | 酒精加入时,立刻产生白雾,当用水浴加热时,不产生气泡,一段时间后,反应瓶内生成黏稠状液体 | 有无色液体 | 溶液不褪色 |
写出实验室用乙醇制乙烯的化学方程式:CH3-CH2-OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)如图装置中冷凝管的作用是冷凝导气
(3)实验1使溴的四氯化碳溶液褪色的物质是CH2=CH2(写结构简式)
(4)根据实验1、2可以推断:
①以P2O5作为催化剂获得乙烯的反应条件是较高温度下或直接加热
②P2O5与95%乙醇在水浴70℃加热条件下(三颈瓶、收集瓶中的液体经检验为磷酸三乙酯)可以发生的有机反应的类型是酯化 反应.
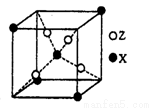
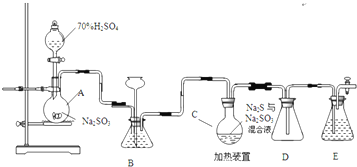
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
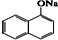
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定. 1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于醇、醚,熔点5.5℃,沸点267.4℃.1乙氧基萘常用作香料,也可作为合成其他香料的原料.
1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于醇、醚,熔点5.5℃,沸点267.4℃.1乙氧基萘常用作香料,也可作为合成其他香料的原料.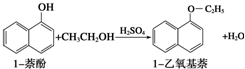
 )
)