题目内容
9. Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.Ⅰ.制备Na2S2O3•5H2O
反应原理:Na2SO3(aq)+S(s)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80mL蒸馏水.另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中.
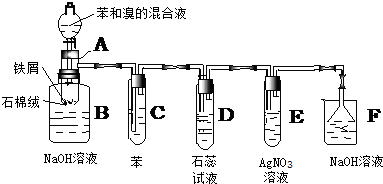
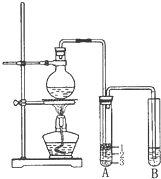
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60min.
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3•5H2O,经过滤、洗涤、干燥,得到产品.回答问题:
(1)硫粉在反应前用乙醇润湿的目的是使硫粉易于分散到溶液中.
(2)仪器a的名称是冷凝管,其作用是冷凝回流.
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是Na2SO4.检验是否存在该杂质的方法是取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4.
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:S2O32?+2H+=S↓+SO2↑+H2O.
分析 (1)硫粉难溶于水、微溶于乙醇,乙醇湿润可以使硫粉易于分散到溶液中;
(2)根据图示装置中仪器构造写出其名称,然后根据冷凝管能够起到冷凝回流的作用进行解答;
(3)由于S2O32?具有还原性,易被氧气氧化成硫酸根离子可知杂质为硫酸钠;根据检验硫酸根离子的方法检验杂质硫酸钠;
(4)S2O32?与氢离子在溶液中能够发生氧化还原反应生成硫单质,据此写出反应的离子方程式.
解答 解:(1)硫粉难溶于水微溶于乙醇,所以硫粉在反应前用乙醇湿润是使硫粉易于分散到溶液中,
故答案为:使硫粉易于分散到溶液中;
(2)根据题中图示装置图可知,仪器a为冷凝管,该实验中冷凝管具有冷凝回流的作用,
故答案为:冷凝管;冷凝回流;
(3)S2O32?具有还原性,能够被氧气氧化成硫酸根离子,所以可能存在的杂质是硫酸钠;检验硫酸钠的方法为:取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4,
故答案为:Na2SO4; 取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4;
(4)S2O32?与氢离子发生氧化还原反应生成淡黄色硫单质,反应的离子方程式为:S2O32?+2H+=S↓+SO2↑+H2O,
故答案为:S2O32?+2H+=S↓+SO2↑+H2O.
点评 本题考查了化学实验基本操作方法及常见仪器的构造、离子的检验方法、离子方程式的书写等知识,题目难度中等,试题涉及的题量较大,知识点较多,充分考查了学生对所学知识的掌握情况.

练习册系列答案
相关题目
6.下列关于氧化还原反应的叙述正确的是( )
| A. | H2还原CuO的反应只属于还原反应 | |
| B. | 置换反应都是氧化还原反应,所以3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2既是置换反应又是氧化还原反应 | |
| C. | 3O2$\frac{\underline{\;电火花\;}}{\;}$2O3是氧化还原反应 | |
| D. | 复分解反应一定不是氧化还原反应 |



 实验室制取少量溴乙烷的装置如下图所示,根据题意完成下列填空:
实验室制取少量溴乙烷的装置如下图所示,根据题意完成下列填空: