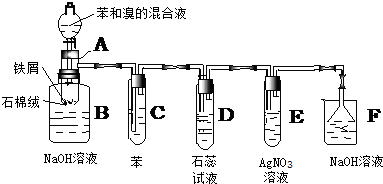
题目内容
5.工业上用CO生产燃料甲醇.一定温度和容积条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.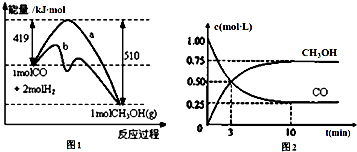
请回答下列问题:
(1)在“图1”中,曲线b(填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g)?CH3OH(g)的△H=-91kJ•mol-1.
(2)下列说法正确的是ABC
A.起始充入的CO的物质的量为1mol
B.增加CO的浓度,H2的转化率会增大
C.容器中压强恒定时,反应达到平衡状态
(3)从反应开始到建立平衡,v(CO)=0.075mol•L-1•min-1;达到平衡时,c(H2)=0.5mo/L,该温度下CO(g)+2H2(g)?CH3OH(g)的化学平衡常数表达式为K=$\frac{c(CH{\;}_{3}OH)}{c(CO)c(H{\;}_{2}){\;}^{2}}$.达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡正向移动 (填“正向”、“逆向”或“不”).
(4)已知CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g);△H=-193kJ/mol,又知H2O(l)=H2O(g);△H=+44kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-281kJ/mol.
分析 (1)根据图中反应的活化能的大小来分析是否使用催化剂,利用反应前后的总能量来分析反应的能量变化;
(2)A.由图2计算CO起始的量;
B.增加CO浓度,会促进氢气的转化,但本身的转化率降低;
C.该反应为反应前后压强不等的反应;
(3)由图2计算用CO表示的反应速率,再利用反应速率之比等于化学计量数之比来计算氢气的反应速率,c(H2)=v(H2)×△t结合三段式计算达到平衡时,c(H2),化学平衡常数表达式K=$\frac{c(CH{\;}_{3}OH)}{c(CO)c(H{\;}_{2}){\;}^{2}}$;根据压缩体积,压强增大,平衡正向移动;
(4)已知①CH3OH(g)+$\frac{3}{2}$O2=CO2(g)+2H2O(g)△H=-193KJ/mol,②H2O(l)=H2O(g)△=44KJ/mol,
利用盖斯定律将①-②×2计算.
解答 解:(1)由图可知,反应的活化能b的较小,所以b使用的催化剂,该反应中反应物的总能量大于生成物的总能量,该反应为放热反应;
由图可知,反应物为1molCO(g)和2molH2(g),生成物为1molCH3OH(g),△H=419-510=-91 kJ•mol-1,故反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ•mol-1,
故答案为:b;-91kJ•mol-1;
(2)A.由图2可知CO的起始物质的量为1mol/l×1L=1mol,故A正确;
B.增加CO浓度,会促进氢气的转化,氢气的转化率增大,故B正确;
C.该反应为反应前后压强不等的反应,则压强不变时,该反应达到平衡状态,故C正确;
故选:ABC;
(3)由图2可知,反应中减小的CO的浓度为1mol/L-0.25mol/L=0.75mol/L,10min时达到平衡,
则用CO表示的化学反应速率为 $\frac{0.75mol/L}{10min}$=0.075mol•L-1•min-1,
因反应速率之比等于化学计量数之比,则v(H2)=0.075mol•L-1•min-1×2=0.15mol•L-1•min-1;c(H2)=v(H2)×△t=0.15mol•L-1•min-1×10min-1=1.5mol•L-1,
CO(g)+2H2(g)?CH3OH(g)
开始(mol/L) 1 2 0
转化(mol/L) 0.75 1.5 0.75
平衡(mol/L) 0.25 0.5 0.75
所以达到平衡时,c(H2)=0.5mo/L,则化学平衡常数表达式K=$\frac{c(CH{\;}_{3}OH)}{c(CO)c(H{\;}_{2}){\;}^{2}}$,正反应为体积缩小的反应,压缩体积,压强增大,平衡正向移动,
故答案为:0.075mol•L-1•min-1;0.5mo/L; K=$\frac{c(CH{\;}_{3}OH)}{c(CO)c(H{\;}_{2}){\;}^{2}}$;正向;
(4)已知①CH3OH(g)+$\frac{3}{2}$O2=CO2(g)+2H2O(g)△H=-193KJ/mol,②H2O(l)=H2O(g)△=44KJ/mol,
利用盖斯定律将①-②×2可得CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)
△H=(-193kJ/mol)-44KJ/mol×2=-281kJ/mol,
故答案为:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-281kJ/mol.
点评 本题考查物质的量浓度随时间变化的曲线,题目难度中等,正确分析图象得出合理信息是解答本题的关键,注意熟练掌握化学平衡及其影响因素,试题侧重考查学生的分析能力及灵活应用能力.

| A. | 弱电解质 | B. | 强电解质 | C. | 非电解质 | D. | 混合物 |
| A. | 石墨转化为金刚石不是化学反应 | |
| B. | 石墨一定没有金刚石稳定 | |
| C. | 金刚石具有能量一定比石墨高 | |
| D. | 等质量的石墨与金刚石完全燃烧,石墨放出的能量多 |
| A. | 碳碳双键不可旋转所以烯烃一定有顺反异构 | |
| B. | CH2Cl2无同分异构体可以证明CH4是正四面体的结构 | |
| C. | 邻二甲苯只有一种结构可以证明苯分子中无单双健的交替结构 | |
| D. | 乙烯、乙炔是平面型分子可推知CH3-CH=C(CH3)-C≡C-CH3分子中所有的碳原子共面 |
| A. | 氢氧化钡与盐酸反应:OH-+H+=H2O | |
| B. | Fe和盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | Cu和AgNO3溶液反应:Cu+Ag+=Cu2++Ag | |
| D. | 石灰石和醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |