题目内容
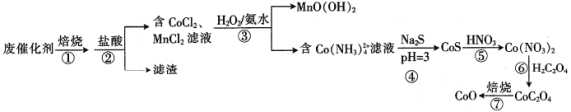
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
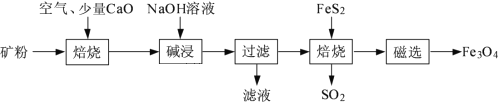
(1)流程中将高硫铝土矿磨成矿粉的目的是_________________________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示。
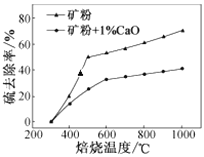
已知:多数金属硫酸盐的分解温度都高于600 ℃;硫去除率=(1—![]() )×100%。
)×100%。
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于____________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________。
(3)由“过滤”得到的滤液生产氧化铝的反应过程中涉及的离子方程式是______________________。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________。
【答案】增大反应的接触面积,加快化学反应速率 FeS2 硫元素转化为CaSO4而留在矿粉中 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-、2Al(OH)3![]() Al2O3+3H2O 1∶16
Al2O3+3H2O 1∶16
【解析】
(1)磨成矿粉,可以增大反应的接触面积,加快化学反应速率;
(2)根据流程图并结合焙烧温度随硫去除率的图像进行分析;
(3)滤液中含有AlO2-,即由AlO2-生产氧化铝;
(4)利用得失电子守恒进行计算;
(1)将高硫铝土矿磨成矿粉,可以增大反应的接触面积,加快化学反应速率;
(2)①由于多数硫酸盐的分解温度高于600度,FeS2在低于500℃焙烧时,能与空气中的氧气反应生成氧化铁和二氧化硫,故不添加氧化钙的矿粉在焙烧时,去除的硫元素主要来源于FeS2;②700℃,焙烧时添加氧化钙后,硫元素转化为硫酸钙而留在矿粉中,使硫矿粉硫去除率降低 ;
(3)滤液中含有AlO2-,用滤液生产氧化铝的反应过程中涉及的离子方程式是AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-、2Al(OH)3![]() Al2O3+3H2O;
Al2O3+3H2O;
(4)分析反应前后元素化合价的变化,利用得失电子守恒知:2/3 n(FeS2)+5×2n(FeS2)=1/3 ×2n(Fe2O3)。解得n(FeS2)∶n(Fe2O3)=1:16;

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案