题目内容
【题目】某课外活动小组同学用如图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.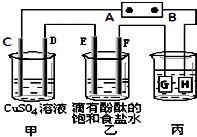
(1)B为电源的极;
(2)在电解一段时间后在甲中加入适量可以使溶液恢复到原来的浓度.
(3)在常温下,现用丙装置给铁镀铜,当丙中铁表面析出铜的3.2g时,乙中溶液的PH值为(假设溶液体积为1L);
(4)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4 , 若将该反应设计为原电池,其正极电极反应式为 .
【答案】
(1)正
(2)CuO或CuCO3
(3)13
(4)4H++O2+4e﹣═2H2O
【解析】解:在C电极表面有铜析出,则C为阴极,可知A为负极,B为正极,则C、E、G为阴极,D、F、H为阳极,(1)在C电极表面有铜析出,则C为阴极,可知A为负极,B为正极,所以答案是:正极;
(2.)甲中发生的反应:2CuSO4+2H2O ![]() 2Cu+O2+2H2SO4 , 由方程式知,电解出的物质有Cu和O2 , 所以加入CuO或CuCO3可以使溶液恢复到原来的浓度,但Cu(OH)2或碱式碳酸铜会使溶液变稀,不能恢复到原来的浓度,所以答案是:CuO或CuCO3;
2Cu+O2+2H2SO4 , 由方程式知,电解出的物质有Cu和O2 , 所以加入CuO或CuCO3可以使溶液恢复到原来的浓度,但Cu(OH)2或碱式碳酸铜会使溶液变稀,不能恢复到原来的浓度,所以答案是:CuO或CuCO3;
(3.)n(Cu)=3.2g÷64g/mol=0.05mol,
丙中:
Cu2+ | + | 2e﹣ | = | Cu |
0.1mol | 0.05mol |
整个装置中电子的得失数相等,故乙中转移电子数也为0.1mol,
乙中的电解反应式为:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑,
阴极电极方程式为:
2H2O | + | 2e﹣ | = | 2OH﹣ | + | H2↑ |
0.1mol | 0.1mol |
故c(OH﹣)=0.1 mol/L,c(H+)=1×10﹣13 mol/L,pH=13,
所以答案是:13;
(4.)原电池正极发生的是化合价降低得电子的反应,根据方程式可知是O2得电子,另外,由于H2SO4存在,所以发生的O2酸性条件下的电极反应:4H++O2+4e﹣═2H2O,所以答案是:4H++O2+4e﹣═2H2O.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案