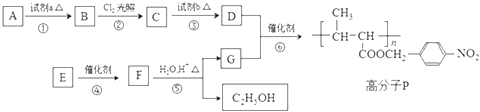
题目内容
【题目】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)![]() 2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
(1)升高温度,反应速率将_________,平衡将如何移动 ;
(2)加入正催化剂,反应速率将_________,平衡将如何移动 ;
(3)充入更多的H2,反应速率将_________,平衡将如何移动 ;
(4)扩大容器的体积,反应速率将_________,平衡将如何移动 ;
(5)容器体积不变,通入氖气,反应速率将___________,平衡将如何移动 ;
【答案】(1)增大 向左 (2)增大 不移动
(3)增大 向右 (4)减小 不移动 (5)不变 不移动
【解析】根据外界因素对化学反应速率影响因素着手,即可解答。
(1)升高温度,正逆反应速率增大,且平衡向左移动。
(2)加入催化剂,正逆反应速率增大,平衡不移动。
(3)充入更多的H2,反应物浓度增大,反应速率增大,平衡向右移动。
(4)扩大容器的体积,反应速率减小,平衡不移动。
(5)容器容积不变,通入氖气,由于反应物的浓度不变,则反应速率不变,平衡不移动。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目