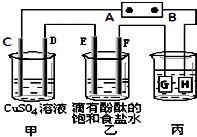
题目内容
【题目】(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是____________(填序号)。
a.电解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
b.高温使水分解制氢:2H2O(g)![]() 2H2+O2
2H2+O2
c.太阳光催化分解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
d.天然气制氢:CH4+H2O(g)![]() CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示。
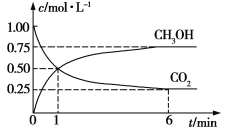
①从1 min到6 min,v(H2)=__________mol·L1·min1。
②能说明上述反应达到平衡状态的是_______(填编号)。
a.总压强保持不变
b.混合气体的密度不随时间的变化而变化
c.H2的体积分数在混合气体中保持不变
d.单位时间内消耗3 mol H2,同时生成1 mol H2O
e.反应中CO2与H2的物质的量之比为1∶3且保持不变
【答案】(1)c (2)①0.15 ②ac
【解析】(1)用水分解或电解都要消耗能源,天然气也是有限资源,只有太阳能是取之不尽用之不竭的能源;观察给出的四个选项,由TiO2作催化剂,利用太阳光分解水制氢气最节能。
(2)①从1 min到6 min,CO2浓度变化为0.25 mol/L,则v(CO2)=0.05 mol/(L·min),根据速率之比等于化学计量数之比,得v(H2)=0.15 mol/(L·min)。②这是一个反应前后气体分子数不相等的反应,故a项说明反应达到平衡状态;混合气体的密度始终不变,故b项不能说明反应达到平衡状态;氢气的体积分数不变,说明各物质的物质的量不再发生变化,故c项说明反应达到平衡状态;单位时间内消耗3 mol H2,同时生成1 mol H2O,表示同一个方向,故d项不能说明反应达到平衡状态;根据加入的量知,反应过程中CO2和H2的物质的量之比始终是1∶3,故e项不能说明反应达到平衡状态。

【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 . 直到因加入一滴盐酸后,溶液由黄色变为橙色,并为止.
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示:所用盐酸溶液的体积为 mL.
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是
(A)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
(B)滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
(C)读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(D)酸式滴定管在滴定前有气泡,滴定后气泡消失
(4)某学生根据三次实验分别记录有关数据如表:请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:(NaOH)=(保留小数点后4位).
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000molL﹣1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |