��Ŀ����
����Ŀ���ȼҵ��������Ļ�ѧ��ҵ֮һ������Ĥ��ⷨΪĿǰ�ձ�ʹ�õ�����������������������ͼ1��ʾ��
��1���������п���ѭ���������� ��
��2����ⷨ�Ƽ����Ҫԭ���DZ���ʳ��ˮ�����ڴ���ˮ�к���Ca2+��Mg2+��SO42���������ʣ������ڽ������ǰ��Ҫ�������ξ��ƣ��õ����Ʊ���ʳ��ˮ��
�ٵ�һ�ξ��ƹ��������ӳ����Լ�˳��������
A��BaCl2��NaOH��Na2CO3��HCl B��BaCl2��Na2CO3��NaOH��HCl
C��NaOH��BaCl2��Na2CO3��HCl D��Na2CO3��BaCl2��NaOH��HCl
��һ�ξ��ƺ��ʳ��ˮ�Ի���������Ca2+��Mg2+ �� ��Ҫ���������ӽ��������ж��ξ��ƣ������������ξ��ƣ�ֱ�ӽ�������Ĥ���ۣ����������ʲô��� ��
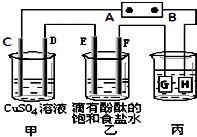
��3��ͼ2�ǹ�ҵ�ϵ�ⱥ��ʳ��ˮ�����ӽ���Ĥ����ʾ��ͼ�������ý��������Ƴɣ�������̼�����Ƴɣ�����A�������������� �� F�缫�������� �� ����ܷ�Ӧ�����ӷ���ʽΪ ��
��4���������۳����ĵ���ˮ�У����������������ܽ��ȣ���Ҫ����8%��9%������������Һ���䳹�׳�ȥ���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��5����֪�ڵ����У�ÿСʱͨ��1A��ֱ���������Ͽ��Բ���1.492g���ռij������300�����۴�������8h���Ƶ�32%���ռ���Һ���ܶ�Ϊ1.342t/m3��113m3 �� ���۵ĵ���ǿ��1.45��104A���õ��۵ĵ��Ч��Ϊ��������λС������
���𰸡�
��1���Ȼ��ơ���������
��2��D�����Լ����������ˮ�л���������Mg2+��Ca2+ �� ���������»����ɳ����������ӽ���Ĥ
��3��H2��������2Cl��+2H2O ![]() Cl2��+H2��+2OH��
Cl2��+H2��+2OH��
��4��Na2SO3+Cl2+H2O=Na2SO4+2HCl
��5��93.45%
���������⣺��1�����ݹ�������ͼ�����õ���ԭ���Լ��������֪���Ȼ��ơ����������ǿ���ѭ��ʹ�õģ����Դ��ǣ��Ȼ��ơ��������ƣ���2�����ȼ���������NaOH����ȥþ���ӣ�Ȼ��������BaCl2 �� ��ȥSO42����CO32�����ټ������Na2CO3 ��ȥCa2+������Ba2+�����˺���Һ�м�����������ᣬ��ȥ��Һ��ʣ���̼��������������е��������������ȳ�ȥʣ����Ȼ��⣬Ҳ���ȼ�BaCl2 �� �ټ���NaOH����Ӧ��֤��������μ���Na2CO3��HCl��Ϊ�˽���������ʳ�����̼���Ʊ�������Ȼ����ĺ��棬��D����
���Դ��ǣ�D���ڴ��������ˮ�л�����������������Mg2+��Ca2+ �� ���������»����ɳ�������װ���еĽ���Ĥ����Ӱ�죬
���Դ��ǣ����Լ����������ˮ�л���������Mg2+��Ca2+ �� ���������»����ɳ����������ӽ���Ĥ����3�������У���������������������������B�ǵ�Դ�ĸ�����A��������E���������������ϲ���������������ⱥ��ʳ��ˮ��ԭ������ʽΪ��2Cl��+2H2O ![]() Cl2��+H2��+2OH�� �� ���Դ��ǣ�H2��������2Cl��+2H2O
Cl2��+H2��+2OH�� �� ���Դ��ǣ�H2��������2Cl��+2H2O ![]() Cl2��+H2��+2OH������4���������������ԣ��ܽ�������������Ϊ�����ƣ���Na2SO3+Cl2+H2O=Na2SO4+2HCl�����Դ��ǣ�Na2SO3+Cl2+H2O=Na2SO4+2HCl����5���ռ���Һ����Ϊ1.342��103kg/m3��113m3=1.516��105kg��
Cl2��+H2��+2OH������4���������������ԣ��ܽ�������������Ϊ�����ƣ���Na2SO3+Cl2+H2O=Na2SO4+2HCl�����Դ��ǣ�Na2SO3+Cl2+H2O=Na2SO4+2HCl����5���ռ���Һ����Ϊ1.342��103kg/m3��113m3=1.516��105kg��
m��NaOH��=1.516��105kg��32%=4.85��104kg��
����������Ҫ������Ϊ ![]() =3.252��107A��
=3.252��107A��
��ʵ���Ϻĵ���Ϊ1.45��104A��8��300=3.48��107A��
�õ��۵ĵ��Ч��Ϊ ![]() ��100%=93.45%��
��100%=93.45%��
���Դ��ǣ�93.45%��