题目内容
【题目】为探究Na与CO2反应产物,某化学兴趣小组按如图装置进行实验。己知:CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3。
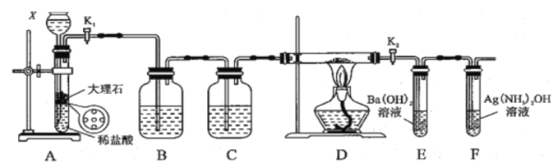
回答下列问题:
(1)写出A中反应的离子方程式__________;
(2)仪器X的名称是_______,B中的溶液为_________;
(3)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g。再进行下列实验操作,其正确顺序是_____(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入CO2至E中出现浑浊 e.称量硬质玻璃管
f.冷却到室温重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
(4)加热硬质玻璃管一段时间,观察到以下现象:①钠块表面变黑,熔融成金属小球;②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;③F中试管内壁有银白物质产生。产生上述②现象的原因是________;
(5)探究固体产物中元素Na的存在形式
假设一:只有Na2CO3;
假设二:只有Na2O;
假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中__________; 现象:_________。 |
(6)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式____。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |
【答案】CaCO3+2H+=Ca2++CO2↑+H2O 长颈漏斗 饱和碳酸氢钠溶液 d、a、b、f、c、e 钠的焰色反应为黄色,钠与二氧化碳反应有碳单质生成 加入足量BaCl2溶液(或足量CaCl2溶液)后滴入酚酞试液(或测pH) 溶液不变红(pH=7) 12Na+11CO2=6Na2C03+C+4CO
【解析】
根据实验目的及反应原理,装置A为碳酸钙与盐酸制取二氧化碳,B为饱和的碳酸氢钠溶液,除HCl装置,C为浓硫酸,干燥装置;D为钠与二氧化碳反应装置;E为除去未反应的二氧化碳,F为验证是否有CO生成的装置。
(1)装置A为碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O;
(2)根据装置特点,X为长颈漏斗;B为除HCl,且不能吸收二氧化碳的装置,盛有饱和的碳酸氢钠溶液;
(3)为了防止钠与空气中的氧气反应,应先通入二氧化碳,并充满整个装置;点燃酒精灯,使反应进行,一段时间后,熄灭酒精灯,继续通入二氧化碳,至玻璃管恢复至室温,称量硬质玻璃管的质量,则顺序为d、a、b、f、c、e;
(4)根据②的实验现象,Na能够在二氧化碳中剧烈反应,钠的焰色反应为黄色,生成黑色的单质碳;
(5)假设一成立时,只含有碳酸钠,则除去溶液中的碳酸根离子(不能消耗溶液中的氢氧根离子)后,溶液呈中性,即向溶液中加入氯化钡或氯化钙溶液,再测定溶液中的pH;
(6)根据表中数据,m(Na)=69.0-66.7=2.3g,n(Na)=0.1mol,根据Na守恒,则n(Na2CO3)=0.05mol,m(Na2CO3)=5.3g,而硬质管的m=72.1-66.7=5.4g,则生成m(C)=5.4-5.3=0.1g,n(C)=![]() mol,方程式中,n(Na):n(Na2CO3):n(C)=12:6:1,反应产物中有CO,根据化合价升降总数相等配平,方程式为12Na+11CO2=6Na2C03+C+4CO。
mol,方程式中,n(Na):n(Na2CO3):n(C)=12:6:1,反应产物中有CO,根据化合价升降总数相等配平,方程式为12Na+11CO2=6Na2C03+C+4CO。

 名校课堂系列答案
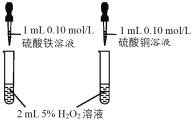
名校课堂系列答案【题目】CuSO4溶液是实验室中常用试剂。下列与CuSO4溶液有关实验的操作和结论都一定正确的是
选项 | A | B | C | D |
实验操作 |
前者产生气泡更快 |
|
Cu片上发生还原反应 |
蒸发CuSO4溶液 |
结论 | Fe3+催化效果好于Cu2+ | Ksp(CuS) < Ksp(ZnS) | Cu片为正极反应物 | 可获得胆矾晶体 |
A.AB.BC.CD.D
【题目】相同温度下,分别在起始体积均为1L的两个密闭容器中发生反应:X2(g)+3Y2(g)![]() 2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
容器 | 反应条件 | 起始物质的量/mol | 达到平衡所用时间 /min | 达到平衡过程中的能量变化 | ||
X2 | Y2 | XY3 | ||||
① | 恒容 | 1 | 3 | 0 | 10 | 放热0.1akJ |
② | 恒压 | 1 | 3 | 0 | t | 放热bkJ |
下列叙述正确的是
A. 对于上述反应,①、②中反应的平衡常数K的数值不同
B. ①中:从开始至10min内的平均反应速率υ(X2)=0.1mol/(L·min)
C. ②中:X2的平衡转化率小于10%
D. b>0.1a