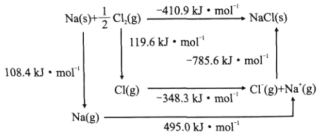
题目内容
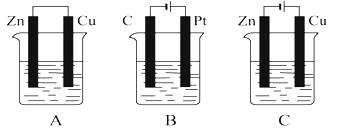
【题目】在如图所示的三个烧杯中均盛有足量的氯化铜溶液。请按要求回答下列问题:
(1)![]() 、
、![]() 、
、![]() 三个装置中不属于电解池的是______。
三个装置中不属于电解池的是______。
(2)![]() 池中
池中![]() 是______极,
是______极,![]() 池中
池中![]() 移向______极(填“
移向______极(填“![]() ”或“
”或“![]() ”)。
”)。
(3)![]() 池中
池中![]() 电极上发生反应__________(填“氧化”或“还原”)
电极上发生反应__________(填“氧化”或“还原”)
(4)![]() 池中
池中![]() 电极上的电极反应为______,反应过程中
电极上的电极反应为______,反应过程中![]() ______(填“变大”“变小”或“不变”)
______(填“变大”“变小”或“不变”)
(5)![]() 池中总反应的化学方程式为______
池中总反应的化学方程式为______
【答案】A 正极 Zn 还原 Cu-2e-=Cu2+ 不变 CuCl2![]() Cu+Cl2↑
Cu+Cl2↑
【解析】
(1)把电能转化为化学能的装置是电解池,所以电解池有外接电源;
(2)该装置是原电池,铜做正极,阴离子向负极移动;
(3)电解池阴极上得电子发生还原反应,惰性材料作电极时,溶液中阴阳离子放电,阳极上氯离子放电,阴极上铜离子放电生成铜;
(4)连接外加电源正极的是阳极,连接外加电源负极的是阴极,阳极是活泼电极,电解池工作时,阳极材料失电子而不是溶液中阴离子失电子,根据阴阳极上发生的反应确定溶液中铜离子浓度是否变化;
(5)惰性电解电解氯化铜溶液,相当于电解溶质氯化铜,据此写出方程式。
(1)B、C装置都有外接电源,所以是把电能转化为化学能的装置,属于电解池;A装置没有外接直流电源,化学能变为电能装置,属于原电池;
综上所述,本题答案是:A。
(2)A装置是原电池,较活泼的金属锌作负极,铜作正极,锌和铜离子发生氧化还原反应生成锌离子和铜单质;溶液中的氯离子向负移动,即向锌极移动;
综上所述,本题答案是:正极;Zn。
(3)B电解池中,C连接外加电源的负极,所以C是阴极,阴极上得电子发生还原反应;
综上所述本题答案是:还原。
(4)C装置为电解池,铜连接外加电源的正极,所以是阳极,铜是活泼电极,所以电解池工作时,阳极上铜失电子生成铜离子而不是溶液中阴离子失电子,电极反应式为Cu-2e-=Cu2+;阴极上铜离子得电子生成铜单质,阳极上溶解的铜等于阴极上析出的铜,所以溶液中铜离子浓度不变;
因此,本题正确答案是: Cu-2e-=Cu;不变。
(5)金属铂做阳极电解氯化铜溶液,阳极氯离子失电子生成氯气,阴极铜离子得电子生成铜,电解总反应的化学方程式为CuCl2![]() Cu+Cl2↑;
Cu+Cl2↑;
综上所述,本题答案是:CuCl2![]() Cu+Cl2↑。
Cu+Cl2↑。

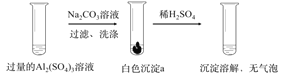
【题目】某学生探究0.25mol/LAl2(SO4)3溶液与0.5mol/LNa2CO3溶液的反应,实验如下。
实验1 |
|
实验2 |
|
下列分析正确的是( )
A. 实验1中,白色沉淀a是Al2(CO3)3
B. 实验2中,白色沉淀b一定是Al2(OH)2(CO3)2
C. 检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液
D. 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关