题目内容
【题目】卤族元素及其化合物的用途非常广泛。回答下列问题:
(1)基态氯原子价电子轨道表示式(电子排布图)为___;处于最高能级电子云轮廓图形状为____。
(2)![]() 和
和![]() 的中心原子相同且杂化方式也相同,它们的键长和键角如下图所示:
的中心原子相同且杂化方式也相同,它们的键长和键角如下图所示:
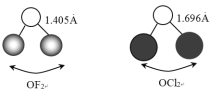
①O-F键的键长比O-Cl键的小,其原因是______。
②键角:∠FOF_____(填“>”、“<”或“=”)∠ClOCl。
(3)①试解释酸性HBrO4>HBrO3的原因_________。
②试解释酸性HClO3>HBrO3>HIO3的原因_________。
(4)![]() 的熔点为1040℃;
的熔点为1040℃;![]() 的熔点为194℃,沸点为181℃,前者的熔点比后者高得多,其原因是______。
的熔点为194℃,沸点为181℃,前者的熔点比后者高得多,其原因是______。
(5)氯化亚铜晶胞结构如图所示,晶胞参数a=0.542nm。
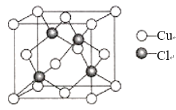
①Cu+的配位数为_____。
②氯化亚铜的密度为____![]() (用含NA的计算式表示)。
(用含NA的计算式表示)。
【答案】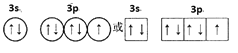 哑铃形(纺锤形) F的原子半径比Cl小,电负性比Cl大 < HBrO3和 HBrO4可分别表示为(HO)BrO2和(HO)BrO3,HBrO3中Br为+5价而HBrO4中Br为+7价。后者正电性更高,导致H、O之间的电子对向O偏移,更易电离出H+。[或非羟基氧个数依次减小(或中心原子价态依次减小)] 中心原子的电负性大小,电负性大的对氧氢键的吸引力就大,于是电子云就会朝氧偏离,从而氢离子就容易脱落,酸性就强。
哑铃形(纺锤形) F的原子半径比Cl小,电负性比Cl大 < HBrO3和 HBrO4可分别表示为(HO)BrO2和(HO)BrO3,HBrO3中Br为+5价而HBrO4中Br为+7价。后者正电性更高,导致H、O之间的电子对向O偏移,更易电离出H+。[或非羟基氧个数依次减小(或中心原子价态依次减小)] 中心原子的电负性大小,电负性大的对氧氢键的吸引力就大,于是电子云就会朝氧偏离,从而氢离子就容易脱落,酸性就强。 ![]() 是离子晶体,
是离子晶体,![]() 是分子晶体 4
是分子晶体 4 ![]()
【解析】
决定键长的因素为原子半径和电负性;决定键角的因素有中心原子的杂化方式、配位原子的电负性、孤对电子等;同一元素不同价态对应的酸,一般化合价越高,导致H、O之间的电子对向O偏移,更易电离出H+,酸性越强(非羟基氧原子数越多酸性越强);元素电负性大的对氧氢键的吸引力就大,于是电子云就会朝氧偏离,从而氢离子就容易脱落,所以对应元素的含氧酸的酸性越强;离子晶体的熔点一般高于分子晶体;晶胞的密度等于质量除以体积,根据均摊法计算每个晶胞含有的离子个数,求每个晶胞的质量,最后得到密度。
(1) 氯原子为17号元素,基态氯原子价电子排布为:3s23p5,轨道表示式(电子排布图)为 ;最高能级为3p,p能级电子云轮廓图形状为哑铃形(纺锤形);
;最高能级为3p,p能级电子云轮廓图形状为哑铃形(纺锤形);
(2)①![]() 和
和![]() 的中心原子均为氧原子,杂化方式均为sp3,决定键长的因素为原子半径和电负性,由于F的原子半径比Cl小,电负性比Cl大,所以O-F键的键长比O-Cl键的小;
的中心原子均为氧原子,杂化方式均为sp3,决定键长的因素为原子半径和电负性,由于F的原子半径比Cl小,电负性比Cl大,所以O-F键的键长比O-Cl键的小;
②由于F的电负性比Cl大,成键电子将偏向F,从而降低成键电子对间的斥力,使得键角:∠FOF<∠ClOCl;
(3)①由于HBrO3和 HBrO4可分别表示为(HO)BrO2和(HO)BrO3,HBrO3中Br为+5价而HBrO4中Br为+7价。后者正电性更高,导致H、O之间的电子对向O偏移,更易电离出H+,所以酸性HBrO4>HBrO3;
②同主族,从上到下,电负性依次减弱,即HClO3、HBrO3、HIO3中心原子的电负性大小Cl>Br>I,电负性大的对氧氢键的吸引力就大,于是电子云就会朝氧偏离,从而氢离子就容易脱落,所以酸性HClO3>HBrO3>HIO3;
(4)氟的电负性大,![]() 的熔点非常高,故
的熔点非常高,故![]() 是离子晶体;
是离子晶体;![]() 的熔点沸点很低,为分子晶体,离子晶体的熔点一般高于分子晶体,所以
的熔点沸点很低,为分子晶体,离子晶体的熔点一般高于分子晶体,所以![]() 的熔点比
的熔点比![]() 高得多;
高得多;
(5)①由图示知,离Cu+的最近的Cl-有4个,Cu+的配位数为4;
②如图,根据均摊法,每个晶胞中含有Cu+![]() ,Cl-有4个,每个晶胞的质量
,Cl-有4个,每个晶胞的质量![]() ,体积
,体积![]() ,根据
,根据![]() ,氯化亚铜的密度为
,氯化亚铜的密度为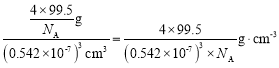 。
。

【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
制备K2FeO4(夹持装置略)
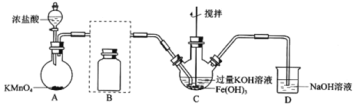
(1)A为氯气发生装置,A中反应离子方程式是:___。
(2)将除杂装置B补充完整并标明所用试剂。___。
(3)C中得到紫色固体和溶液。C中Cl2发生的反应有:3Cl2+2Fe(OH)3+10KOH→2K2FeO4+6KCl+8H2O,另外还有:___。
(4)已知Cl2与KOH在较高温度下反应生成KClO3。为了保证生产KClO,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是:___、__。
探究K2FeO4的性质
(5)高铁酸钾常用于工业废水与城市生活污水的处理,可用作高效水处理剂,表现在水中与污染物作用的过程中,经过一系列反应,由六价降至三价后,能对水产生净化作用的原因是(结合离子方程式回答):____。
(6)取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2,为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
i.由方案I中溶液变红可知a中含有__离子,但该离子的产生不能判断一定K2FeO4将Cl-氧化,还可能由___产生(用离子方程式表示)。
ii.方案II可证明K2FeO4氧化了Cl-。
(7)用KOH溶液洗涤的目的是___。
(8)根据K2FeO4的制备实验得出:氧化性Cl2__FeO42-(填“>”或“<”),而方案II实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是___。
(9)资料表明,酸性溶液中的氧化性FeO42->MnO42-,验证实验如下:
将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性FeO42->MnO42-,若能,请说明理由;若不能,进一步设计实验方案,理由或方案:__。