题目内容
【题目】乙烯可作化工原料和清洁能源,研究其制备和综合利用具有重要意义,请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g)![]() C2H4(g)+H2(g) ΔH制备乙烯。
C2H4(g)+H2(g) ΔH制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ΔH1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+![]() O2(g)=H2O(l) ΔH2=-285.5kJ·mol-1;
O2(g)=H2O(l) ΔH2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) ΔH3=-1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) ΔH3=-1559.9kJ·mol-1。
则ΔH=______kJ·mol-1。
(2)乙烯可制备乙醇:C2H4(g)+H2O(g)![]() C2H5OH(g)。向2L某恒容密闭容器中充入a mol C2H4(g)和a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如下图所示:
C2H5OH(g)。向2L某恒容密闭容器中充入a mol C2H4(g)和a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如下图所示:
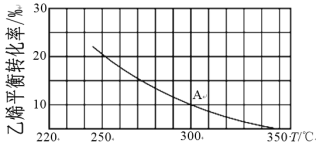
①该反应为______热反应(填“吸”或“放”),理由为____。
②A点时容器中气体的总物质的量为____mol,计算A点对应温度下的平衡常数K=_____(用含a的分数表示)。
③已知:C2H4(g)+H2O(g)![]() C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是____(填选项字母)。
C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是____(填选项字母)。
a.k正增大,k逆减小 b.k正减小,k逆增大c.k正增大的倍数大于k逆 d.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率_____10%(填“>”、“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为_____极(填“阴”或“阳”),对应的电极反应式为______。
【答案】+282.4 放 温度越高,乙烯的平衡转化率越低 1.9a ![]() d > 阳 CH3CHO-2e+H2O=CH3COOH+2H+
d > 阳 CH3CHO-2e+H2O=CH3COOH+2H+
【解析】
根据盖斯定律可计算C2H6(g)C2H4(g)+H2(g)△H的值;根据图像转化率和温度的关系可判断正反应是放热反应;根据A点的转化率由平衡计算的“三段式”可计算混合气体总物质的量及K值;根据升高温度,平衡逆向移动,可判断k正和k逆增大的倍数大小关系;根据可逆反应气体的计量系数减小,而恒压相对于恒容,压强更大,正向移动,可推出转化率增大;根据电解池中,阳极失去电子,发生氧化反应,据此解答。
(1)由盖斯定律Ⅲ-Ⅱ-Ⅰ得C2H6(g)C2H4(g)+H2(g) △H=(-1559.9kJmol-1)-(-285.5kJmol-1)-(-1556.8kJmol-1)=+282.4kJmol-1;答案为:+282.4。
(2)①由图可知,温度越高,乙烯的平衡转化率越低,平衡逆向移动,说明正反应是放热反应;答案为放,温度越高,乙烯的平衡转化率越低,平衡逆向移动。
②由图可知,A点时乙烯的平衡转化率为10%, 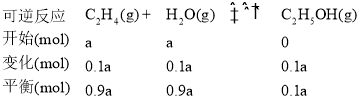
混合气体总物质的量=(0.9+0.9+0.1)amol=1.9amol,A点对应温度下的平衡常数K= ![]() =
= 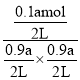 =
= ![]() ;答案为1.9a,
;答案为1.9a,![]() 。
。
③平衡时,正、逆反应速率相等,即K=![]() =
=![]() ,升高温度,正、逆反应速率都增大,即k正和k逆均增大,但由于正反应是放热反应,平衡逆向移动,K减小,故k正增大的倍数小于k逆;答案为d;
,升高温度,正、逆反应速率都增大,即k正和k逆均增大,但由于正反应是放热反应,平衡逆向移动,K减小,故k正增大的倍数小于k逆;答案为d;
④正反应为气体物质的量减小的反应,平衡时,与恒容容器相比,恒压密闭容器压强更大,反应正向进行程度更大,C2H4(g)的平衡转化率更高,大于10%;答案为>。
(3)乙醛生成乙酸,碳元素的化合价升高,失去电子,被氧化,发生氧化反应,因而乙醛在阳极发生氧化反应生成乙酸,电极反应式为CH3CHO-2e-+H2O═CH3COOH+2H+;答案为阳, CH3CHO-2e-+H2O═CH3COOH+2H+。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案