题目内容
5.在密闭容器中,将1.0molCO与1.0molH2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g).一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.则下列说法正确的是( )| A. | 427℃时该反应的平衡常数为9.4,则该反应的△H>0 | |
| B. | 800℃下,该反应的化学平衡常数为0.25 | |
| C. | 同温下,若继续向该平衡体系中通入1.0mol的H2O(g),则平衡时H2O(g)转化率为66.7% | |
| D. | 同温下,若继续向该平衡体系中通入1.0mol的CO(g),则平衡时H2O(g)物质的量分数为11.1% |
分析 在密闭容器中,将1.0molCO与1.0molH2O混合加热到800℃,一段时间后该反应达到平衡,测得CO的物质的量为0.5mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):1 1 0 0
变化量(mol):0.5 0.5 0.5 0.5
平衡量(mol):0.5 0.5 0.5 0.5
反应前后气体的体积不变,可以用物质的量代替浓度计算平衡常数,则800℃该反应平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.5×0.5}{0.5×0.5}$=1.
A.427℃时该反应的平衡常数为9.4,大于800℃平衡常数K=1,说明降低温度平衡正向移动,则正反应为放热反应;
B.由上述计算可知,800℃该反应平衡常数K=1;
C.同温下,若继续向该平衡体系中通入1.0mol的H2O(g),水的转化率小于原平衡;
D.温度不变,平衡常数不变,等效为开始加入2.0molCO与1.0molH2O到达的平衡,设平衡时转化的CO为xmol,表示出平衡时各物质的物质的量,再根据平衡常数列方程计算解答.
解答 解:在密闭容器中,将1.0molCO与1.0molH2O混合加热到800℃,一段时间后该反应达到平衡,测得CO的物质的量为0.5mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):1 1 0 0
变化量(mol):0.5 0.5 0.5 0.5
平衡量(mol):0.5 0.5 0.5 0.5
反应前后气体的体积不变,可以用物质的量代替浓度计算平衡常数,则800℃该反应平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.5×0.5}{0.5×0.5}$=1.
A.427℃时该反应的平衡常数为9.4,大于800℃平衡常数K=1,说明降低温度平衡正向移动,则正反应为放热反应,故△H<0,故A错误;
B.由上述计算可知,800℃该反应平衡常数K=1,故B错误;
C.原平衡中水的转化率为50%,同温下,若继续向该平衡体系中通入1.0mol的H2O(g),水的转化率小于原平衡,故新平衡时H2O(g)转化率<50%,故C错误;
D.等效为开始加入2.0molCO与1.0molH2O到达的平衡,设平衡时转化的CO为xmol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):2 1 0 0
变化量(mol):x x x x
平衡量(mol):2-x 1-x x x
温度不变,平衡常数不变,则$\frac{x×x}{(2-x)×(1-x)}$=1,解得x=$\frac{2}{3}$,则平衡时平衡时H2O(g)物质的量分数为$\frac{1mol-\frac{2}{3}mol}{3mol}$×1005=11.1%,故D正确,
故选:D.
点评 本题考查化学平衡计算,涉及平衡常数影响因素与应用,C选项中可以利用平衡常数计算具体的值,注意利用平衡移动分析解答,避免计算的繁琐,难度中等.

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案| A. | 已知2C(s)+O2(g)═2CO(g)△H=-221kJ/mol,则C的燃烧热为110.5kJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ/mol | |
| D. | 已知:C(s)+O2(g)=CO2(g)△H1 C(s)+$\frac{1}{2}$O2(g)=CO (g)△H2,则△H1>△H2 |
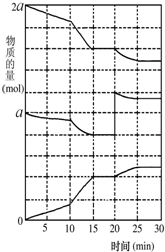 实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应:2A(g)+B(g)?2C(g);?△H=QkJ/mol
实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应:2A(g)+B(g)?2C(g);?△H=QkJ/mol(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如表:
| 实验 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | n2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | n3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 7 0℃ | 1.0 | 0.90 | 0.80 | 0.75 | 0.70 | 0.65 | 0.65 |
①在实验1中反应在10至20min内反应的平均速率Vc=0.0065mol•L-1•min-1,实验2中采取的措施是使用催化剂;实验3中n3>1.0mol(填“>、=、<”).
②比较实验4和实验1,可推测该反应中Q<0(填“>、=、<”),
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的abd.
a.10~15min可能是升高了温度 b.10~15min可能是加入了催剂
c.20min时可能缩小了容器体积 d.20min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA(g)和3molB(g),此时容器的压强为P(始).反应进行并达到平衡后,测得容器内气体压强为P(始)的$\frac{7}{8}$.若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的$\frac{7}{8}$.
①a、b、c必须满足的关系是a+c=5,b+$\frac{1}{2}$c=3.(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是3<a≤5.
| A. | CH3COOH | B. | CuSO4 | C. | K2SO4 | D. | NaHCO3 |
| A. | 钠和铁 | B. | 镁和铜 | C. | 铝和镁 | D. | 锌和铁 |
| A. | 液态氯化氢 | B. | 盐酸 | C. | 酒精 | D. | 食盐晶体 |
 (氧化剂)
(氧化剂)