题目内容
下列是工业上制取合成氨原料气氢气的一步重要反应:CO(g)+H2O(g)  CO2(g)+H2(g) △H<0 ,该反应达到平衡后,为提高CO的转化率,下列措施中正确的是
CO2(g)+H2(g) △H<0 ,该反应达到平衡后,为提高CO的转化率,下列措施中正确的是
| A.增大压强 | B.降低温度 | C.增大CO的浓度 | D.更换催化剂 |
B
解析试题分析:提高CO的转化率可以让平衡正向进行即可.A、增加压强,该平衡会不会发生移动,A错误;B、降低温度,化学平衡向着放热方向即正向进行,B正确;C、增大CO的浓度,化学平衡向着正方向进行,但是一氧化碳的转化率降低,C错误;D、催化剂不会引起化学平衡的移动,D错误.
故选B.
考点:化学平衡的影响因素

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
下列事实不能用勒夏特列原理解释的是( )
A.氯水中有平衡:Cl2+H2O HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 |
B.对CO(g)+NO2(g) CO2(g)+NO(g),平衡体系增大压强可使颜色变深 CO2(g)+NO(g),平衡体系增大压强可使颜色变深 |
C.对2NO2(g)  N2O4(g), 升高温度平衡体系颜色变深 N2O4(g), 升高温度平衡体系颜色变深 |
| D.SO2催化氧化成SO3的反应,往往加入过量的空气 |
在一个不导热的恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g) CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
| A.反应物浓度:a点小于c点 |
| B.c点时反应进行的程度最大 |
| C.该反应的正反应为吸热反应 |
| D.△t1=△t2时,生成H2的物质的量:a~b段小于b~c段 |
已知 (CH3COOH)2 (g)  2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量(
2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量(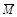 =
= )随温度(T)的变化曲线如图所示,下列说法正确的是
)随温度(T)的变化曲线如图所示,下列说法正确的是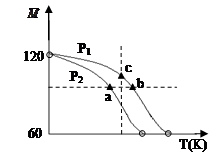
| A.该过程的△H < 0 |
| B.气体压强:P(a) < P(b) = P(c) |
| C.平衡常数:K(a) =" K(b)" < K(c) |
| D.测定乙酸的相对分子质量要在高压、低温条件 |
COCl2(g) CO(g)+Cl2(g); △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g); △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
| A.①②④ | B.①④⑥ | C.②③⑥ | D.③⑤⑥ |
温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生PCl5(g)  PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是
PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是
| A.反应在0 ~50 s 的平均速率v(Cl2) =1.6×10-3mol/(L·s) |
| B.该温度下,反应的平衡常数K = 0.025 |
| C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则该反应的ΔH <0 |
| D.反应达平衡后,再向容器中充入 1 mol PCl5,该温度下再达到平衡时,0.1 mol/L<c(Cl2)<0.2 mol/L |


 ,5min内氨的质量增加了1.7g,则反应速率为( )
,5min内氨的质量增加了1.7g,则反应速率为( )



 C(g)+D(g)已达平衡状态的是( )
C(g)+D(g)已达平衡状态的是( ) 2SO3并达到平衡。在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是
2SO3并达到平衡。在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是