题目内容
已知 (CH3COOH)2 (g)  2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量(
2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量(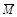 =
= )随温度(T)的变化曲线如图所示,下列说法正确的是
)随温度(T)的变化曲线如图所示,下列说法正确的是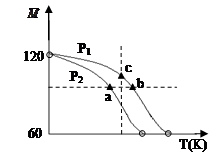
| A.该过程的△H < 0 |
| B.气体压强:P(a) < P(b) = P(c) |
| C.平衡常数:K(a) =" K(b)" < K(c) |
| D.测定乙酸的相对分子质量要在高压、低温条件 |
B
解析试题分析:A、升高温度,M减小,则平衡向气体物质的量增大方向移动,说明正反应是吸热反应,其△H>0,错误;B、其他条件保持不变,增大压强,平衡向气体物质的量减小方向移动,则M增大,读图可知,P2<P1,正确;C、温度:a<c<b,升温平衡右移,则平衡常数增大,故K(a) <K(c) < K(b),错误;D、(CH3COOH)2 (g)  2CH3COOH(g)的正反应是气体体积增大的吸热反应,低压、高温时乙酸蒸气增多,而高压、低温时乙酸蒸气减少,错误。
2CH3COOH(g)的正反应是气体体积增大的吸热反应,低压、高温时乙酸蒸气增多,而高压、低温时乙酸蒸气减少,错误。
考点:考查化学平衡等相关知识。

利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
反应一:Ni(粗,s)+4CO(g) Ni(CO)4(g) ΔH < 0
Ni(CO)4(g) ΔH < 0
反应二:Ni(CO)4(g) Ni(纯,s)+4CO(g) ΔH > 0
Ni(纯,s)+4CO(g) ΔH > 0
下列说法错误的是
| A.对于反应一,适当增大压强,有利于Ni(CO)4的生成 |
| B.提纯过程中,CO气体可循环使用 |
| C.升高温度,反应一的反应速率减小,反应二的速率增大 |
| D.对反应二,在180—200℃,温度越高,Ni(CO)4(g)的转化率越高 |
在容积相同的五个密闭容器中分别放入等量的A2和B2,在不同温度下同时任其发生反应:A2(g)+3B2(g) 2AB3(g),分别在某一同时刻测得其中AB3所占的体积分数变化如图所示,下列说法不正确的是
2AB3(g),分别在某一同时刻测得其中AB3所占的体积分数变化如图所示,下列说法不正确的是
| A.正反应是放热反应 | B.E、F二点尚未达到平衡 |
| C.H、I二点尚未达到平衡 | D.G、H、I三点已达平衡状态 |
下列是工业上制取合成氨原料气氢气的一步重要反应:CO(g)+H2O(g)  CO2(g)+H2(g) △H<0 ,该反应达到平衡后,为提高CO的转化率,下列措施中正确的是
CO2(g)+H2(g) △H<0 ,该反应达到平衡后,为提高CO的转化率,下列措施中正确的是
| A.增大压强 | B.降低温度 | C.增大CO的浓度 | D.更换催化剂 |
将固体NH4I置于密闭容器中,在某温度下,发生反应:
NH4I(气) NH3(气)+HI(气),2HI(气)
NH3(气)+HI(气),2HI(气) H2(气)+I2(气)
H2(气)+I2(气)
当反应达到平衡时,c(H2)=0.5mol/L,c(HI)= 4mol/L,则NH3的浓度为
| A.3.5mol/L | B.4.5mol/L | C.4mol/L | D.5mol/L |
一定温度下,向体积为2L的恒容密闭容器中充入1mol PCl5(g),发生反应:PCl5(g) PCl3(g)+Cl2(g) △H=+Q KJ/mol维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是( )
PCl3(g)+Cl2(g) △H=+Q KJ/mol维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是( )
| A.3s内的平均速率为:V(PCl3)=0.1mol·L-1·min-1 |
| B.达到平衡时放出0.6QKJ热量 |
| C.其他条件不变,再向容器中充入1molPCl5(g),则达新平衡 时,C(PCl5)>0.4mol·L-1 |
| D.其他条件不变,增大PCl5的浓度,平衡常数减小 |
已知反应2D+E 3F+2G,用传感器测得该反应在不同pH条件下,物质D的浓度(用每升溶液所含溶质的质量表示,单位为mg/L)变化如图所示,下列有关说法正确的是
3F+2G,用传感器测得该反应在不同pH条件下,物质D的浓度(用每升溶液所含溶质的质量表示,单位为mg/L)变化如图所示,下列有关说法正确的是
| A.pH=6.8时,D的浓度(mg/L)一定最大 |
| B.在pH相同的条件下,增大压强,D的浓度(mg/L)增大 |
| C.调节pH到8.8,可使该反应正、逆反应速率都为0 |
| D.温度相同时,不同pH条件下,该反应的平衡常数相同 |
一定条件下,恒容的密闭容器中,加入一定量的A与B发生反应:A(s)+2B(g) C(g)+2D(g) ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是( )
C(g)+2D(g) ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是( )
| A.增加A的物质的量,正反应速率加快 |
| B.平衡时,其他条件不变,当温度升高时,θ变大 |
| C.图中曲线的斜率表示反应的化学平衡常数 |
| D.平衡时,其他条件不变,再通人B,则反应混合物的温度升高 |
在温度、容积相同的2个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ·mol-1)
2NH3(g) △H=-92.4 kJ·mol-1)
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1 mol N2、3 mol H2 | 4 mol NH3 |
| NH3的浓度(mol·L-1) | c1 | c2 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ |
| 气体密度 | ρ1 | ρ2 |
| 反应物转化率 | α1 | α2 |
下列说法正确的是
A.c1<c2<2 c1 B.a+b>92.4 C.α1 +α2=1 D.ρ2=2ρ1