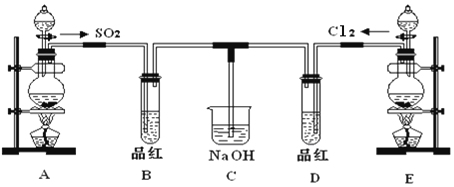
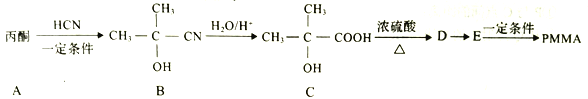
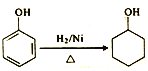
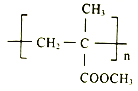题目内容
【题目】常温下,下列有关离子浓度及pH大小的比较,正确的是( )
A. NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序是:③>②>①
B. 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C. pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合后,混合溶液的pH>7
D. pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13<pH<14
【答案】D
【解析】①(NH4)2Fe(SO4)2溶液中Fe2+的水解对于铵根离子的水解起到抑制作用, ②(NH4)2CO3 中碳酸根离子水解对于铵根离子的水解起到促进作用,③(NH4)2SO4溶液中硫酸根离子对铵根离子的水解无影响,所以溶液中铵根离子的水解程度的大小顺序为:②>③>①。则要达到相同的铵根离子浓度,水解程度大的溶液,物质的浓度应该越大,即溶液浓度由大到小的顺序是:②>③>①。选项A错误。由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,由于醋酸的浓度远大于氢氧化钠的浓度,所以中和以后得到醋酸钠(较少)和醋酸(较多)的混合溶液,溶液显酸性,即c(H+)>c(OH-),根据电荷守恒得到:c(CH3COO-)>c(Na+)。又因为钠离子是醋酸钠完全电离生成的,氢离子使醋酸微弱电离得到的,所以有c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。选项B错误。pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合,两溶液的氢氧根离子和氢离子的浓度刚好相等,等体积混合,恰好中和,溶液显中性。选项C错误。pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,其![]() ,所以
,所以![]() ,
, ![]() ,选项D正确。
,选项D正确。
【题型】单选题
【结束】
14
【题目】室温下,下列溶液中粒子浓度关系正确的是( )
A. Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+c(H2C2O4)
B. 20mL0.1molL-1CH3COONa溶液与10mL0.1molL-1HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C. CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
D. pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-)
【答案】B
【解析】碳酸钠溶液的质子守恒为:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),选项A错误。20mL0.1molL-1CH3COONa溶液与10mL0.1molL-1HCl溶液混合后得到c(CH3COONa)= c(CH3COOH)= c(NaCl)的混合溶液。溶液显酸性,说明CH3COOH的电离大于CH3COONa的水解,得到:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),选项B正确。CH3COONa的物料守恒为c(Na+)=c(CH3COO-)+c(CH3COOH),CaCl2溶液中一定有2c(Ca2+)= 2c(Cl-),两个等式相加得到:c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-),选项C错误。溶液有电荷守恒:c(Cl-)+c(OH-)=c(NH4+)+ c(H+),即c(Cl-)=c(NH4+)+ c(H+)- c(OH-),将其带入题目给的式子得到:c(NH4+)+ c(H+)- c(OH-)+c(H+)>c(NH4+)+c(OH-),化简得到c(H+)>c(OH-),即如果题目的结论是对的,则溶液一定显酸性。题目是pH=2的盐酸与pH=12的氨水等体积混合,因为氨水的浓度远大于盐酸,最后一定是氨水完全过量,溶液显碱性,选项D错误。