题目内容
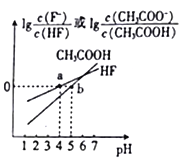
【题目】常温下,将NaOH溶液分别加到HF溶液、CH3COOH溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,已知pKa=-lgKa,下列有关叙述错误的是
A. 常温下,Ka(CH3COOH)=10-5
B. a点时,c(F-)=c(HF)>c(Na+)>c(H+)>c(OH-)
C. 常温下,0.1mol/LNaF溶液的pH小于0.1mol/LCH3COONa溶液的pH
D. 向CH3COOH溶液中加入NaOH溶液后所得的混合溶液中, 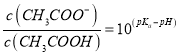
【答案】D
【解析】A、根据b点信息,可知pH=5时, 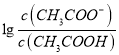 =0,即
=0,即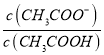 =1。所以Ka(CH3COOH)=
=1。所以Ka(CH3COOH)= 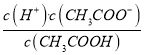 =c(H+)=10-5,故A正确。B、根据a点信息可知,pH=4,c(H+)>c(OH-),
=c(H+)=10-5,故A正确。B、根据a点信息可知,pH=4,c(H+)>c(OH-), 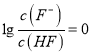 ,则c(F-)=c(HF);根据电荷守恒c(F-)+c(OH-)=c(H+)+c(Na+),则c(F-)>c(Na+),所以c(F-)=c(HF)>c(Na+)>c(H+)>c(OH-),故B正确。C、根据a点信息可知,Ka(HF)= c(H+)=10-4>Ka(CH3COOH);越弱越水解,所以同浓度的NaF溶液和CH3COONa溶液,后者水解程度较大,pH较大,故C正确。D、根据Ka(CH3COOH)=
,则c(F-)=c(HF);根据电荷守恒c(F-)+c(OH-)=c(H+)+c(Na+),则c(F-)>c(Na+),所以c(F-)=c(HF)>c(Na+)>c(H+)>c(OH-),故B正确。C、根据a点信息可知,Ka(HF)= c(H+)=10-4>Ka(CH3COOH);越弱越水解,所以同浓度的NaF溶液和CH3COONa溶液,后者水解程度较大,pH较大,故C正确。D、根据Ka(CH3COOH)= 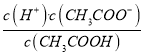 可知,
可知, 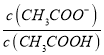 =
=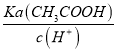 =
=![]() =10
=10![]() ,故D错误。故选D。
,故D错误。故选D。

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目