题目内容
【题目】一定温度下,在三个体积均为2.5L的恒容密闭容器中发生反应:CO2(g)+H2S(g)COS(g)+H2O(g)
容器 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
CO2 | H2S | H2O | |||
Ⅰ | 607 | 0.11 | 0.41 | 0.01 | / |
Ⅱ | 607 | 0.22 | 0.82 | / | |
Ⅲ | 620 | 0.1 | 0.4 | / | 6.74×10﹣3 |
下列说法正确的是( )
A.该反应正反应为放热反应
B.607K时该反应的平衡常数为2.50×10﹣3
C.容器Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D.容器Ⅲ达平衡时,再充入少量氦气,平衡将向正反应方向移动
【答案】BC
【解析】解:
A、
CO2(g) | + | H2S(g) | COS(g) | + | H2O(g) | |
初始量: | 0.11 | 0.41 | 0 | |||
变化量: | 0.01 | 0.01 | 0.01 | |||
平衡量: | 0.1 | 0.4 | 0.01 |
反应前后系数和相等,所以此时K= ![]() =
= ![]() =0.0025<6.74×10﹣3 , 温度升高,K增大,所以反应是吸热的过程,故A错误;
=0.0025<6.74×10﹣3 , 温度升高,K增大,所以反应是吸热的过程,故A错误;
B、607K时该反应的平衡常数为2.50×10﹣3 , 故B正确;
C、根据前两组实验,体积不变,初始投料增加1倍,则达到平衡时各物质的物质的量加倍,Ⅱ达到平衡时容器中COS的物质的量为0.02mol,故C正确;
D、容器Ⅲ达平衡时,再充入少量氦气,各物质的浓度不变,所以平衡不移动,故D错误.
故选BC.
【考点精析】利用化学平衡的计算对题目进行判断即可得到答案,需要熟知反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

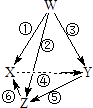
【题目】下列图示箭头方向表示与某种常见试剂在通常条件下(不含电解)发生转化,其中6步转化均能一步实现的一组物质是( )
选项 | W | X | Y | Z |
|
A | N2 | NH3 | NO | NO2 | |
B | Na | Na2O2 | NaOH | Na2CO3 | |
CC | Cu | CuSO4 | CuCl2 | Cu(OH)2 | |
D | Al | Al2(SO4)3 | AlCl3 | NaAlO2 |
A.A
B.B
C.C
D.D
【题目】三乙酸甘油酯是一种优良的溶剂、定香剂和增塑剂.实验室制备三乙酸甘油酯的反应原理、实验装置及相关数据如下:3CH3COOH+ ![]()
![]()
![]() +3H2O
+3H2O
物质 | 相对 | 密度/gcm﹣3 | 沸点/℃ | 水中 |
甘油 | 92 | 1.2636 | 290 | 溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
三乙酸甘油酯 | 218 | 1.1596 | 258 | 不溶 |

实验步骤:
步骤1.在500mL反应器中加入200g冰醋酸,92g甘油和100mL苯,开动搅拌器,慢慢从插温度计口加入3mL浓硫酸后,缓缓加热并回流1h,停止加热.
步骤2.用5%碳酸钠溶液洗涤,再用水洗涤,最后加入无水氯化钙.
步骤3.先进行常压蒸馏收集75~85℃馏分.
步骤4.将常压馏分再进行减压蒸馏,收集128~131℃/933Pa馏分,最终得产品176g.
(1)步骤1先开搅拌器后加浓硫酸的目的是;冰醋酸过量的目的是
(2)用5%碳酸钠溶液洗涤的主要目的是;加无水氯化钙的目的是
(3)最后用减压蒸馏而不用常压蒸馏其原因是
(4)本次实验产率为 .