题目内容
升高温度,下列数据不一定增大的是
| A.化学反应速率v | B.水的离子积常数Kw |
| C.化学平衡常数K | D.醋酸的电离平衡常数Ka |
C
试题分析:由于反应是放热反应还是吸热反应不能确定,所以升高温度化学平衡常数不一定是增大的,但升高温度反应速率一定增大。电离是吸热的,因此升高温度水的离子积常数和电离平衡常数都是一定增大的,答案选C。
点评:该题是高考中的常见题型,试题基础性强,注重考查学生的灵活应变能力。该题有利于培养学生的发散思维能力,提高学生的答题效率。

练习册系列答案
相关题目
 H2(g)+CO2(g),反应过程中测定的部分数据见下表:
H2(g)+CO2(g),反应过程中测定的部分数据见下表:
 2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。
2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。 C(气) (正反应为放热反应)达到平衡后,根据下列图象判断:
C(气) (正反应为放热反应)达到平衡后,根据下列图象判断:
 xC(g),2min时反应达到平衡状态(温度不变),剩余了O.8 mol B,并测得C的浓度为O.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了O.8 mol B,并测得C的浓度为O.4 mol/L,请填写下列空白: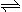 2NO2 (g) ΔH<0,
2NO2 (g) ΔH<0,
 2SO3(g) ΔH ="-98.3" kJ·mol-1。
2SO3(g) ΔH ="-98.3" kJ·mol-1。