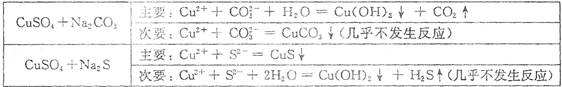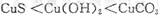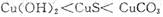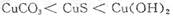题目内容
(1)钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4。该过程的化学方程式可表示为__________________________________________。
(2)为测定过程中混合气的SO2体积分数,选用0.0500 mol/L I2的标准溶液、淀粉溶液进行测定。已知:V(耗用I2标准溶液)="10.00" mL,V(采集烟气)="100.0" mL(已折算为标准状况),则烟气中SO2 的体积分数为_____________________。
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图9所示。试分析工业生产中采用常压的原因是____________________。
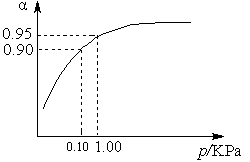
图9
(4)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。
已知:2SO2(g)+O2(g) 2SO3(g) ΔH ="-98.3" kJ·mol-1。
2SO3(g) ΔH ="-98.3" kJ·mol-1。
则:α1+α2=_________________,p=________________mol,b+c=_______________kJ。
(2)为测定过程中混合气的SO2体积分数,选用0.0500 mol/L I2的标准溶液、淀粉溶液进行测定。已知:V(耗用I2标准溶液)="10.00" mL,V(采集烟气)="100.0" mL(已折算为标准状况),则烟气中SO2 的体积分数为_____________________。
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图9所示。试分析工业生产中采用常压的原因是____________________。

图9
(4)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。
已知:2SO2(g)+O2(g)
 2SO3(g) ΔH ="-98.3" kJ·mol-1。
2SO3(g) ΔH ="-98.3" kJ·mol-1。| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2 mol SO2、1 mol O2 | 2 mol SO3 | m mol SO2、n mol O2、 p mol SO3 |
| c(SO3) /mol·L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
则:α1+α2=_________________,p=________________mol,b+c=_______________kJ。
(1)SO2+V2O5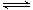 SO3+ V2O4(3分)
SO3+ V2O4(3分)
(2)0.112(3分)
(3)使用常压SO2就可以达到较高的转化率。(3分)
(4)1(2分), 1.6(2分),39.32(2分)
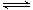 SO3+ V2O4(3分)
SO3+ V2O4(3分)(2)0.112(3分)
(3)使用常压SO2就可以达到较高的转化率。(3分)
(4)1(2分), 1.6(2分),39.32(2分)
(1)根据反应物和生成物可知,方程式为SO2+V2O5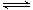 SO3+ V2O4。
SO3+ V2O4。
(2)SO2和碘反应的方程式为SO2+I2+2H2O=H2SO4+2HI,所以SO2的物质的量是0.0500 mol/L×0.01L=0.0005mol,其体积是0.0005mol×22.4L/mol=0.0112L,所以烟气中SO2 的体积分数为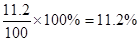 。
。
(3)根据图像可知使用常压SO2就可以达到较高的转化率,而增大压强会增加生产成本。
(4)根据甲、乙、丙可知平衡均是等效的。甲是反应物开始建立平衡,乙是生成物开始建立平衡,所以SO2和SO3的转化率之和是1。丙中SO3的转化率是0.125,平衡时SO3的物质的量是1.4mol,所以有p×(1-0.125)=1.4mol,解得p=1.6mol。根据反应式可知每消耗2mol三氧化硫,就吸收98.3 kJ热量,丙中消耗的三氧化硫是1.6mol×0.125=0.2mol,吸热是0.2×98.3 kJ/2=9.83kJ。乙中消耗三氧化硫是0.6mol×98.3 kJ/2=29.49kJ。所以共吸热29.49kJ+9.83kJ=39.32kJ。
 SO3+ V2O4。
SO3+ V2O4。(2)SO2和碘反应的方程式为SO2+I2+2H2O=H2SO4+2HI,所以SO2的物质的量是0.0500 mol/L×0.01L=0.0005mol,其体积是0.0005mol×22.4L/mol=0.0112L,所以烟气中SO2 的体积分数为
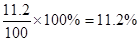 。
。(3)根据图像可知使用常压SO2就可以达到较高的转化率,而增大压强会增加生产成本。
(4)根据甲、乙、丙可知平衡均是等效的。甲是反应物开始建立平衡,乙是生成物开始建立平衡,所以SO2和SO3的转化率之和是1。丙中SO3的转化率是0.125,平衡时SO3的物质的量是1.4mol,所以有p×(1-0.125)=1.4mol,解得p=1.6mol。根据反应式可知每消耗2mol三氧化硫,就吸收98.3 kJ热量,丙中消耗的三氧化硫是1.6mol×0.125=0.2mol,吸热是0.2×98.3 kJ/2=9.83kJ。乙中消耗三氧化硫是0.6mol×98.3 kJ/2=29.49kJ。所以共吸热29.49kJ+9.83kJ=39.32kJ。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
 3C(g);经2 s后达到平衡,测得C气体的浓度
3C(g);经2 s后达到平衡,测得C气体的浓度 2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法正确的是
2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法正确的是 2C(气)若经 2 秒后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:①用物质 A 表示反应的平均速率为 0.3 mol·L-1·s-1②用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1③ 2 s 时物质 A 的转化率为30% ④ 2 s 时物质 B 的浓度为 1.4 mol·L-1 ,其中正确的是
2C(气)若经 2 秒后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:①用物质 A 表示反应的平均速率为 0.3 mol·L-1·s-1②用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1③ 2 s 时物质 A 的转化率为30% ④ 2 s 时物质 B 的浓度为 1.4 mol·L-1 ,其中正确的是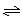 C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( ) 2SO3(g);已知反应过程中某一时刻,SO2、O2、SO3分别是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是
2SO3(g);已知反应过程中某一时刻,SO2、O2、SO3分别是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是