题目内容
在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力如图1-14-1所示,请回答:
(1)“0”点导电能力为0的理由______。
(2)a,b,c三点溶液的pH值由小到大的顺序为______。
(3)a,b,c三点中电离度最大的是:______。
(4)若使c点溶液中[CH3COO-]增大,溶液的pH值也增大,可采取的措施为:
①______;②______;③______。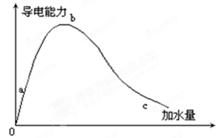
(1)“0”点导电能力为0的理由______。
(2)a,b,c三点溶液的pH值由小到大的顺序为______。
(3)a,b,c三点中电离度最大的是:______。
(4)若使c点溶液中[CH3COO-]增大,溶液的pH值也增大,可采取的措施为:
①______;②______;③______。

(1)由于醋酸为共价化合物,在固、液态时不存在离子,也就谈不上存在自由移动的离子,所以不导电。
(2)b<a<c;(3)c;(4)加NaOH(固);Mg;Na2CO3(固)。
(2)b<a<c;(3)c;(4)加NaOH(固);Mg;Na2CO3(固)。
【错解分析】错答 (1)由于冰醋酸为固态,所以不导电。
(2)c<b<a;(3)b;(4)加热。
【正解】冰醋酸不导电,从表面上看是由于其状态原因造成。其实质是本身结构为共价化合物,不存在离子,也不存在自由移动的离子,因此不导电。
从导电能力上看,在b点醋酸的导电能力最强,说明溶液中自由移动离子浓度最大,其离子应为醋酸电离的氢离子和醋酸根离子,相应在a点、c点的氢离子浓度逐渐减小。由于思维定势误将该顺序视为pH值由小到大的顺序,pH值是氢离子浓度的负对数值,恰好与氢离子浓度大小顺序相反,因此结论为b<a<c。
为了使醋酸根离子浓度增大,而溶液的pH值也增大,只能是减小氢离子浓度,使电离平衡向右移动。采取的措施可以添加较活泼的金属、金属氧化物、碱和比醋酸弱的盐。本小题的误区是:加热促进醋酸的电离,醋酸根离子浓度增大,氢离子浓度也增大,与上小题同样的错误,pH值也增大。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表: CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入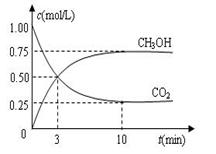
 2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )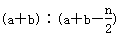
 2C(g)在定容密闭容器中达到平衡的标志的是:①C的生成速率与C的分解速率相等;②单位时间内amol A生成,同时生成3amolB;③A、B、C的浓度不再变化;④混合气体的总压强不再变化;⑤混合气体的平均摩尔质量不再变化;⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2;⑦A、B、C的分子数目比为1:3:2;⑧混合气体的密度不再变化
2C(g)在定容密闭容器中达到平衡的标志的是:①C的生成速率与C的分解速率相等;②单位时间内amol A生成,同时生成3amolB;③A、B、C的浓度不再变化;④混合气体的总压强不再变化;⑤混合气体的平均摩尔质量不再变化;⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2;⑦A、B、C的分子数目比为1:3:2;⑧混合气体的密度不再变化 SiF4(g)+ 2H2O(g) ΔH =" —148.9" kJ/mol
SiF4(g)+ 2H2O(g) ΔH =" —148.9" kJ/mol 3C(g);经2 s后达到平衡,测得C气体的浓度
3C(g);经2 s后达到平衡,测得C气体的浓度 2SO3(g);已知反应过程中某一时刻,SO2、O2、SO3分别是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是
2SO3(g);已知反应过程中某一时刻,SO2、O2、SO3分别是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是