��Ŀ����
��800��ʱ�����ݻ�Ϊ2L�ĺ����ܱ������г���һ������CO��H2Oά�ֺ��£�������ӦCO(g)+H2O(g)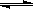 H2(g)+CO2(g)����Ӧ�����вⶨ�IJ������ݼ��±���
H2(g)+CO2(g)����Ӧ�����вⶨ�IJ������ݼ��±���
�ٷ�Ӧ��2 min�ڵ�ƽ������Ϊv(H2O)��___________��
��800��ʱ����ѧƽ�ⳣ��K��ֵΪ_______________��
�۱��������������䣬��ƽ����ϵ����ͨ��0.20 mol H2O����ԭƽ����ȣ��ﵽ��ƽ��ʱCOת����______�������С�����䡱����
���ں��º�ѹ�ܱ�������ͨ��CO��H2O��1 mol�����÷�Ӧ������Ӧ�ﵽƽ���ά���¶���ѹǿ���䣬t1ʱ��ͨ���1 mol��CO��H2O�Ļ�����壬������ͼ�л�����(v��)����(v��)��Ӧ������t1����ʱ��t�仯������ͼ��

��.ʵ���������ø��ֽⷴӦ��ȡMg(OH)2��ʵ�����ݺ��������±���ʾ����Һ�����ȡ��1mL����
������III�� ��
�������0.028 mol/L��MgCl2��Һ�м���������NaOH��Һ�������NaOH��Һ��Ũ�����ٴﵽ
mol/Lʱ����Һ�п�ʼ���ְ�ɫ������Ksp(Mg(OH)2)= 5.6��10-12����
��MgCl2��Һ�Ͱ�ˮ��Ϻ�������л�ѧƽ�⣺Mg2+(aq) + 2NH3��H2O(aq) 2NH4+(aq) + Mg(OH)2(s)�÷�Ӧ��ѧƽ�ⳣ���ı���ʽΪK= ���г��÷�Ӧƽ�ⳣ��K��Kb(NH3��H2O)��Ksp(Mg(OH)2)�Ĺ�ϵʽ ��
2NH4+(aq) + Mg(OH)2(s)�÷�Ӧ��ѧƽ�ⳣ���ı���ʽΪK= ���г��÷�Ӧƽ�ⳣ��K��Kb(NH3��H2O)��Ksp(Mg(OH)2)�Ĺ�ϵʽ ��
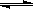 H2(g)+CO2(g)����Ӧ�����вⶨ�IJ������ݼ��±���
H2(g)+CO2(g)����Ӧ�����вⶨ�IJ������ݼ��±���| ��Ӧʱ��/min | 0 | 2 | 4 | 6 |
| n(CO)/mol | 1.20 | 0.90 | | 0.80 |
| n(H2O)/ mol | 0.60 | | 0.20 | |
�ٷ�Ӧ��2 min�ڵ�ƽ������Ϊv(H2O)��___________��
��800��ʱ����ѧƽ�ⳣ��K��ֵΪ_______________��
�۱��������������䣬��ƽ����ϵ����ͨ��0.20 mol H2O����ԭƽ����ȣ��ﵽ��ƽ��ʱCOת����______�������С�����䡱����
���ں��º�ѹ�ܱ�������ͨ��CO��H2O��1 mol�����÷�Ӧ������Ӧ�ﵽƽ���ά���¶���ѹǿ���䣬t1ʱ��ͨ���1 mol��CO��H2O�Ļ�����壬������ͼ�л�����(v��)����(v��)��Ӧ������t1����ʱ��t�仯������ͼ��

��.ʵ���������ø��ֽⷴӦ��ȡMg(OH)2��ʵ�����ݺ��������±���ʾ����Һ�����ȡ��1mL����
| ��� | ҩƷ1 | ҩƷ2 | ʵ������ |
| I | 0.01 mol/L NaOH��Һ | 0.01 mol/L MgCl2��Һ | ���ɰ�ɫ���� |
| II | 0.01 mol/L��ˮ | 0.01 mol/L MgCl2��Һ | ������ |
| III | 0.1 mol/L��ˮ | 0.1 mol/L MgCl2��Һ | ����III |
| IV | 0.1 mol/L��ˮ | 0.01 mol/L MgCl2��Һ | ���ɰ�ɫ���� |
| V | 0.01 mol/L��ˮ | 0.1 mol/L MgCl2��Һ | ������ |
������III�� ��
�������0.028 mol/L��MgCl2��Һ�м���������NaOH��Һ�������NaOH��Һ��Ũ�����ٴﵽ
mol/Lʱ����Һ�п�ʼ���ְ�ɫ������Ksp(Mg(OH)2)= 5.6��10-12����
��MgCl2��Һ�Ͱ�ˮ��Ϻ�������л�ѧƽ�⣺Mg2+(aq) + 2NH3��H2O(aq)
 2NH4+(aq) + Mg(OH)2(s)�÷�Ӧ��ѧƽ�ⳣ���ı���ʽΪK= ���г��÷�Ӧƽ�ⳣ��K��Kb(NH3��H2O)��Ksp(Mg(OH)2)�Ĺ�ϵʽ ��
2NH4+(aq) + Mg(OH)2(s)�÷�Ӧ��ѧƽ�ⳣ���ı���ʽΪK= ���г��÷�Ӧƽ�ⳣ��K��Kb(NH3��H2O)��Ksp(Mg(OH)2)�Ĺ�ϵʽ ������15�֣��� ��0.075 mol��L��1��min��1��2�֣� ��1��2�֣� ������(1��)
�� ��2�֣�
��2�֣�
�� �����ɰ�ɫ������2�֣� ��4��10-5 mol��L��1��2�֣���K�� ��
��
K��Kb2/Ksp����2�֣�
��
 ��2�֣�
��2�֣��� �����ɰ�ɫ������2�֣� ��4��10-5 mol��L��1��2�֣���K��
 ��
��K��Kb2/Ksp����2�֣�
�����������.�ٸ��ݱ������ݿ�֪����Ӧ��2 minʱCO�����ʵ���������1.20mol��0.90mol��0.30mol�����ݷ���ʽ��֪��ˮ���������ʵ���Ҳ����0.30mol����Ũ����0.30mol��2L��0.15mol/L������2min�ڵ�ƽ������Ϊv(H2O)��
 ��0.075 mol��L��1��min��1��
��0.075 mol��L��1��min��1����2minʱˮ���������ʵ�����0.30mol��3minʱ��0.20mol������0.10mol����3minʱCO�����ʵ�����0.80mol������4minʱCO�����ʵ���Ҳ��0.8mol����˵����Ӧ��3minʱ�ﵽƽ��״̬����
CO(g)+H2O(g)
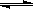 H2(g)+CO2(g)
H2(g)+CO2(g)��ʼŨ�ȣ�mol/L�� 0.60 0.30 0 0
ת��Ũ�ȣ�mol/L�� 0.20 0.20 0.20 0.20
ƽ��Ũ�ȣ�mol/L�� 0.40 0.10 0.20 0.20
����ƽ�ⳣ��K��
 ��1.0
��1.0�۱��������������䣬��ƽ����ϵ����ͨ��0.20 mol H2O������ˮ������Ũ�ȣ�ƽ��������Ӧ������У����CO��ת��������
��ά���¶���ѹǿ���䣬t1ʱ��ͨ���1 mol��CO��H2O�Ļ�����壬���������ݻ���Ȼ�������ڷ�Ӧǰ��������䣬����ƽ���ǵ�Ч�ġ�������Ӧ���������淴Ӧ���ʼ�С����ƽ��״̬���䣬�����ȷ��ͼ����
 ��
���� �ٸ��ݱ������ݿ�֪��ʵ���͢���ȣ���ˮ��Ũ����ͬ��ʵ������Ȼ�þ��Ũ�ȸ���ʵ������Ȼ�þ��Ũ�ȡ�����ʵ������а�ɫ����������þ���ɣ��������Ԣ���һ�����ɰ�ɫ����������þ��
����NaOH��Һ��Ũ�����ٴﵽx�����������Һ����OH��Ũ��0.5x�����ڻ�Ϻ���Һ��þ����Ũ����0.014mol/L������Ҫ����������þ��������(0.5x)2��0.014��5.6��10-12�����x��4��10-5 mol/L��
�ۻ�ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ�����Ը��ݷ���ʽ��֪���ÿ��淴Ӧ��ƽ�ⳣ��K��
 ��K��
��K��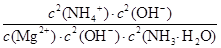 ��Kb2/Ksp��
��Kb2/Ksp��
��ϰ��ϵ�д�
�����Ŀ
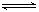 2NH3(g) ��H��0 ����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
2NH3(g) ��H��0 ����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺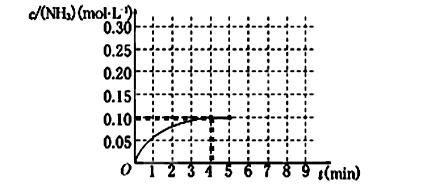
 CH3CH2OH(g)����ͼ����ϩ��ת�������¶ȡ�ѹǿ�ı仯��ϵ������˵����ȷ���ǣ� ��
CH3CH2OH(g)����ͼ����ϩ��ת�������¶ȡ�ѹǿ�ı仯��ϵ������˵����ȷ���ǣ� ��
 C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£� 2P��g��+Q��s����Ӧ�����±�����Ͷ�ϣ���Ӧ�ﵽƽ��״̬�������ϵѹǿ���ߣ������÷�Ӧ��ƽ�ⳣ�����¶ȵı仯��ϵ��__________________________________________________________________________________��
2P��g��+Q��s����Ӧ�����±�����Ͷ�ϣ���Ӧ�ﵽƽ��״̬�������ϵѹǿ���ߣ������÷�Ӧ��ƽ�ⳣ�����¶ȵı仯��ϵ��__________________________________________________________________________________�� CH3OH(g)+H2O(g) ��H <0 ��500 ��ʱ�������Ϊ1 L�Ĺ̶��ݻ����ܱ������г���1mol CO2��3mol H2�����CO2Ũ����CH3OH Ũ����ʱ��ı仯��ͼ��ʾ�����еó��Ľ��۴������
CH3OH(g)+H2O(g) ��H <0 ��500 ��ʱ�������Ϊ1 L�Ĺ̶��ݻ����ܱ������г���1mol CO2��3mol H2�����CO2Ũ����CH3OH Ũ����ʱ��ı仯��ͼ��ʾ�����еó��Ľ��۴������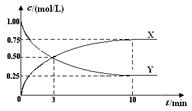


 ��1����֪��Ӧһ������������Ͻ����ͻᴦ�ں���״̬��д�����������Ļ�ѧ����ʽ��______________________________________________�����¶�����ʱ���÷�Ӧ��ƽ�ⳣ��Kֵ___________(���������С�����䡱)��
��1����֪��Ӧһ������������Ͻ����ͻᴦ�ں���״̬��д�����������Ļ�ѧ����ʽ��______________________________________________�����¶�����ʱ���÷�Ӧ��ƽ�ⳣ��Kֵ___________(���������С�����䡱)�� 2NH3���÷�Ӧ�ڹ̶��ݻ����ܱ������н��С����и����־�Ÿ÷�Ӧ�ﵽ��ѧƽ��״̬����____________(�����)
2NH3���÷�Ӧ�ڹ̶��ݻ����ܱ������н��С����и����־�Ÿ÷�Ӧ�ﵽ��ѧƽ��״̬����____________(�����)
 CO2(g)+H2(g)��CO��ת���ʺ��¶�t�Ĺ�ϵ���±���
CO2(g)+H2(g)��CO��ת���ʺ��¶�t�Ĺ�ϵ���±��� CH3OH(g)+H2O(g) ��H��-49.0 kJ��mol��1���������Ϊ1 L���ܱ������У�����
CH3OH(g)+H2O(g) ��H��-49.0 kJ��mol��1���������Ϊ1 L���ܱ������У�����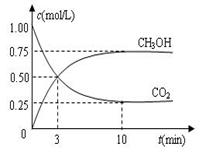
 CH3OH��g����
CH3OH��g����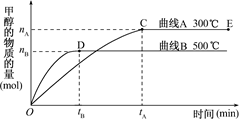
 cC��g��+ dD��g��������ͼ�ش�
cC��g��+ dD��g��������ͼ�ش�