题目内容
8.有机物分子中所有的原子不可能处在同一平面的是( )| A. | 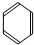 | B. | 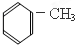 | C. | 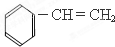 | D. | 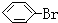 |
分析 根据苯环为平面结构、乙烯为平面结构以及乙炔为直线结构来分析各物质的共面原子.
解答 解:A.苯是平面正六边形,所有原子在同一平面上,故A错误;
B.甲苯中有1个甲基,具有甲烷的结构,所有原子不可能处于同一平面内,故B正确;
C.苯和乙烯都是平面结构,故苯乙烯所有原子可能在同一平面上,故C错误;
D.苯是平面结构,溴苯中溴原子取代氢原子的位置,所有原子可能在同一平面上,故D错误.
故选B.
点评 本题主要考查有机物的共面知识的认识,难度不大,注意结合苯环为平面结构、乙烯为平面结构以及乙炔为直线结构解题.

练习册系列答案
相关题目
19.在一定量的偏铝酸钠溶液中,加入下列哪一种溶液可使获得的沉淀量最大( )
| A. | 硫酸铝 | B. | 盐酸 | C. | 二氧化碳 | D. | 硫酸 |
3.下列说法正确的是( )
| A. | 碱金属单质的熔点、沸点随着原子序数的递增而逐渐降低 | |
| B. | 过渡元素可用于制备半导体材料 | |
| C. | 碱金属单质的密度随着原子序数的递增而逐渐增大 | |
| D. | 含有离子键的化合物一定是离子化合物 |
11.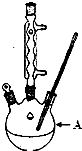 苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸
(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
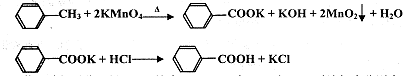
已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g.
实验流程:
①往装置A中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加入8.5g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热.
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品.
③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如表所示.
请回答:
(1)装置A的名称三颈烧瓶.若不用温度计,本实验控制反应温度的措施为沸水浴加热.
(2)白色粗产品中除了KCl外,其他可能的无机杂质为MnCl2.
(3)操作②中趁热过滤的目的是防止苯甲酸结晶析出,减少其损失,操作I的名称过滤、干燥.
(4)步骤③中用到的定量仪器有分析天平,100mL容量瓶,50mL酸式、碱式滴定管.
(5)样品中苯甲酸纯度为96.00%.
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将偏小(填“偏大”、“偏小”或“不变”).
 苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)

已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g.
实验流程:
①往装置A中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加入8.5g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热.
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品.
③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如表所示.
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(1)装置A的名称三颈烧瓶.若不用温度计,本实验控制反应温度的措施为沸水浴加热.
(2)白色粗产品中除了KCl外,其他可能的无机杂质为MnCl2.
(3)操作②中趁热过滤的目的是防止苯甲酸结晶析出,减少其损失,操作I的名称过滤、干燥.
(4)步骤③中用到的定量仪器有分析天平,100mL容量瓶,50mL酸式、碱式滴定管.
(5)样品中苯甲酸纯度为96.00%.
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将偏小(填“偏大”、“偏小”或“不变”).
8.下列制定微粒的数目相等的是( )
| A. | 等n的水与重水含有的中子数 | |
| B. | 等n的铁分别与足量氯气和硫完全反应时转移的电子数 | |
| C. | 等m的乙烯和丙烯中含有的共用电子对数 | |
| D. | 同温、同压同体积的CO和NO含有的质子数 |
9.下列说法正确的是( )
| A. | 自发进行的化学反应不一定是放热反应 | |
| B. | 自发过程将导致体系的熵增大 | |
| C. | △H-T△S<0的反应,不需要任何条件就可自发进行 | |
| D. | 同一物质的气、液、固三种状态的熵值依次增大 |
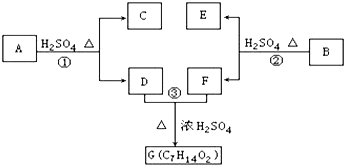
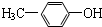 ;
;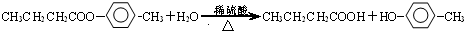 ;
;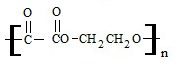 +2nH2O.
+2nH2O.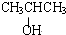 ;写出生成G的化学方程式CH3CH2CH2COOH+
;写出生成G的化学方程式CH3CH2CH2COOH+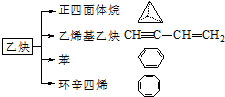 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.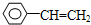 .
. 、
、 .
. ,试写出有关化学反应方程式:CH≡CH+HCl$→_{△}^{催化剂}$CH2=CHCl,nCH2=CHCl$\stackrel{一定条件}{→}$
,试写出有关化学反应方程式:CH≡CH+HCl$→_{△}^{催化剂}$CH2=CHCl,nCH2=CHCl$\stackrel{一定条件}{→}$ .
.