题目内容
20.下列各种说法不正确的是( )| A. | 仅用溴水一种试剂可将苯、己烯、乙醇、四氯化碳、亚硫酸钠溶液五种物质鉴别开来 | |
| B. | Na2O2中既含离子键又含共价键,其所含的阳离子对阴离子的个数比为2:1 | |
| C. | 甲烷、新戊烷与2,2,3,3-四甲基丁烷的一氯代物均只有一种 | |
| D. | 硬脂酸(C17H35COOH)与乙酸、甲醇与乙二醇(HOCH2CH2OH)均互为同系物关系 |
分析 A.苯、己烯、乙醇、四氯化碳、亚硫酸钠溶液分别与溴水混合的现象为:分层后有机色层在上层、溴水褪色且分层、无现象、分层后有机色层在下层、无色溶液;
B.Na2O2中由2个钠离子与1个过氧根离子构成;
C.甲烷、新戊烷与2,2,3,3-四甲基丁烷结构对称,均只有一种H;
D.同系物中官能团的数目应相同.甲醇与乙二醇中-OH的数目不同.
解答 解:A.苯、己烯、乙醇、四氯化碳、亚硫酸钠溶液分别与溴水混合的现象为:分层后有机色层在上层、溴水褪色且分层、无现象、分层后有机色层在下层、无色溶液,现象不同,可鉴别,故A正确;
B.Na2O2中含离子键和O-O共价键,由2个钠离子与1个过氧根离子构成,则阳离子对阴离子的个数比为2:1,故B正确;
C.甲烷、新戊烷与2,2,3,3-四甲基丁烷结构对称,均只有一种H,则一氯代物均只有一种,故C正确;
D.同系物中官能团的数目应相同,则硬脂酸(C17H35COOH)与乙酸,互为同系物,而甲醇与乙二醇中-OH的数目不同,不是同系物,故D错误;
故选D.
点评 本题考查物质的鉴别和检验,为高频考点,把握有机物的结构与性质、一氯代物及同系物的判断等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
19.在一定量的偏铝酸钠溶液中,加入下列哪一种溶液可使获得的沉淀量最大( )
| A. | 硫酸铝 | B. | 盐酸 | C. | 二氧化碳 | D. | 硫酸 |
11.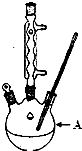 苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸
(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g.
实验流程:
①往装置A中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加入8.5g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热.
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品.
③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如表所示.
请回答:
(1)装置A的名称三颈烧瓶.若不用温度计,本实验控制反应温度的措施为沸水浴加热.
(2)白色粗产品中除了KCl外,其他可能的无机杂质为MnCl2.
(3)操作②中趁热过滤的目的是防止苯甲酸结晶析出,减少其损失,操作I的名称过滤、干燥.
(4)步骤③中用到的定量仪器有分析天平,100mL容量瓶,50mL酸式、碱式滴定管.
(5)样品中苯甲酸纯度为96.00%.
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将偏小(填“偏大”、“偏小”或“不变”).
 苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)

已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g.
实验流程:
①往装置A中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加入8.5g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热.
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品.
③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如表所示.
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(1)装置A的名称三颈烧瓶.若不用温度计,本实验控制反应温度的措施为沸水浴加热.
(2)白色粗产品中除了KCl外,其他可能的无机杂质为MnCl2.
(3)操作②中趁热过滤的目的是防止苯甲酸结晶析出,减少其损失,操作I的名称过滤、干燥.
(4)步骤③中用到的定量仪器有分析天平,100mL容量瓶,50mL酸式、碱式滴定管.
(5)样品中苯甲酸纯度为96.00%.
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将偏小(填“偏大”、“偏小”或“不变”).
8.下列制定微粒的数目相等的是( )
| A. | 等n的水与重水含有的中子数 | |
| B. | 等n的铁分别与足量氯气和硫完全反应时转移的电子数 | |
| C. | 等m的乙烯和丙烯中含有的共用电子对数 | |
| D. | 同温、同压同体积的CO和NO含有的质子数 |
5.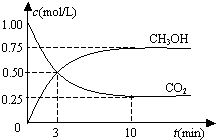 恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:
恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得其中CO2和CH3OH(g)浓度随时间变化如图.下列说法错误的是( )
 恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:
恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得其中CO2和CH3OH(g)浓度随时间变化如图.下列说法错误的是( )
| A. | 该密闭容器的体积为1 L | |
| B. | 反应达平衡,氢气的转化率为0.75 | |
| C. | 反应达平衡,氢气平均反应速率0.075 mol/(L•min) | |
| D. | CO2或H2O物质的量不再改变时反应达平衡 |
9.下列说法正确的是( )
| A. | 自发进行的化学反应不一定是放热反应 | |
| B. | 自发过程将导致体系的熵增大 | |
| C. | △H-T△S<0的反应,不需要任何条件就可自发进行 | |
| D. | 同一物质的气、液、固三种状态的熵值依次增大 |
10.下列各选项中两种粒子所含电子数不相等的是( )
| A. | 羟甲基(-CH2OH)和甲氧基(-OCH3) | B. | 亚硝酸(HNO2)和亚硝酸根(NO2-) | ||
| C. | 硝基(-NO2)和二氧化氮(NO2) | D. | 羟基(-OH)和氢氧根(OH-) |
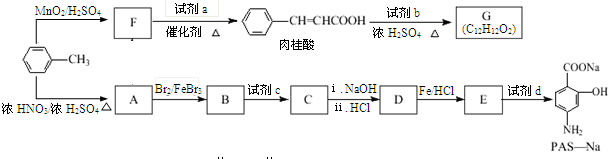
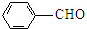 $→_{催化剂.△}^{RCH_{2}C-O-CCH_{2}R}$
$→_{催化剂.△}^{RCH_{2}C-O-CCH_{2}R}$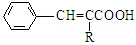 (R=CCOOH(R=-CH3或-H)
(R=CCOOH(R=-CH3或-H)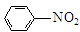 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$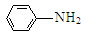
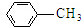 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$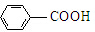
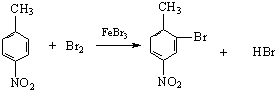 .
. .
.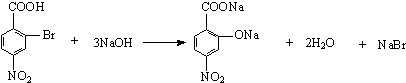 .
.