题目内容
关于化学平衡常数、电离平衡常数、水的离子积常数和溶解平衡常数,下列说法正确的是
| A.四种平衡常数都是一个比值,没有单位 |
| B.四种平衡常数都是温度的函数,温度升高其值都增大 |
| C.一个化学反应的平衡常数与物质的计量数无关 |
| D.对于同类型反应,化学平衡常数K的大小反映了化学反应可能进行的程度 |
D
解析试题分析:A、化学平衡常数、电离平衡常数、水的离子积常数和溶解平衡常数都是一个比值,但是有的含有单位,故A错误;B、平衡常数都是温度的函数,随温度变化做相应的变化,电离平衡常数、水的离子积常数和溶解平衡常数温度升高其值都增大,但是化学平衡常数随温度的变化和反应的吸放热情况有关,故B错误;C、一个化学反应的平衡常数与物质的计量数有关,故C错误;D、对于同类型反应,化学平衡常数K的意义可以反映化学反应可能进行的程度,故D正确。
考点:本题考查平衡常数的含义及影响因素。

已知X(g)+3Y(g)═ 2Z(g)△H>0,下列对该反应的说法中正确的是
| A.△S>0 |
| B.逆向能自发进行,且反应速率和平衡常数均较大 |
| C.反应物总能量大于生成物总能量 |
| D.在任何温度下都不能自发进行 |
用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,当反应达到平衡时,下列说法正确的是( )
| A.18O只存在于乙酸乙酯中 | B.18O存在于水、乙酸、乙醇以及乙酸乙酯中 |
| C.18O存在于乙酸乙酯、乙醇中 | D.若与丙酸反应生成酯的相对分子质量为102 |
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
下列描述正确的是
| A.反应开始到10s,用Z表示的反应速率为0.158 mol·L-1·s-1 |
| B.反应开始到10s,X的物质的量浓度减少了0.79 mol·L-1 |
| C.反应开始到10s,Y的转化率为79.0% |
D.反应的化学方程式为:X(g) + Y(g) Z(g) Z(g) |
在一个恒温恒容的密闭容器中发生如下反应,2A(g)+ B(s)  C(g)+3D(g),不能说明该反应达到平衡的是( )
C(g)+3D(g),不能说明该反应达到平衡的是( )
| A.气体总质量不变 | B.混合气体密度不变 |
| C.反应物B的浓度不变 | D.混合气体平均相对分子质量不再改变 |
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是①升高温度;②改用100mL 3mol/L盐酸;③改用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液
| A.①②④⑤ | B.①③④⑤ | C.①②③④ | D.①②④ |
在一定温度下,反应:2A(s)+2B(g)  C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是
| A.单位时间内生成2a mol B,同时生成a molD |
| B.C的质量不再改变 |
| C.容器内的压强不随时间而变化 |
| D.混合气体的密度不再随时间而变化 |
工业制硫酸中的一步重要反应是SO2(在400-500 C下的催化氧化:2SO2+O2
C下的催化氧化:2SO2+O2 2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述有关说法错误的是
2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述有关说法错误的是
| A.在上述条件下,SO2可能100%的转化为SO3 |
| B.使用催化剂是为了加快反应速率,提高生产效率 |
| C.达到平衡时,SO2与SO3的浓度保持不变 |
| D.为了提高SO2的转化率,可以适当提高O2的浓度 |
25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )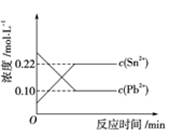
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 |
| D.25 ℃时,该反应的平衡常数K=2.2 |