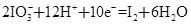题目内容
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下: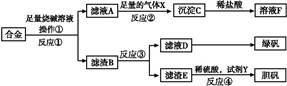
请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式: ,反应②的离子反应方程式: 。
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选) 。
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3·6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是 。
将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3·6H2O 晶体,而不用直接蒸发结晶的方法来制得晶体的理由是 。
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO)。
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | V |
则硝酸的浓度为 ;③中溶解铜的质量为 ;④中V= 。
(1)烧杯、漏斗、玻璃棒
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)取少量滤液D加入NaOH溶液,产生白色沉淀,白色沉淀迅速变成灰绿色最后变成红褐色(合理即可)
(4)Cu+H2O2+H2SO4+3H2O=CuSO4·5H2O(或Cu+H2O2+H2SO4=CuSO4+2H2O)
(5)铁粉与杂质铜形成原电池,加快了反应速率 因为氯化铁是强酸弱碱盐水解生成氢氧化铁和盐酸,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3·6H2O 晶体
(6)2 mol/L 4.8 g 4.48
解析

某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Fe3+、Al3+、Cu2+、Mg2+):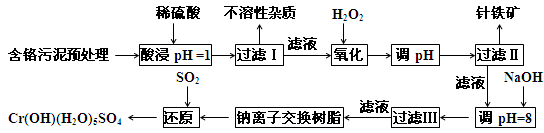
常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 9.3 | 3.7 | 4.7 | --- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 6.7 | 9(>9 溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是____________________(至少写一条)。
(2)加入H2O2 目的是氧化_______离子,其有关的离子方程式______________________。针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、H、O,化学式量为89,其化学式是______________。
(3)调pH=8是为了将_____________离子(从Fe3+、Al3+、Cu2+、Mg2+中选择)以氢氧化物沉淀的形式除去。滤出的沉淀中部分沉淀将溶解于足量的氢氧化钠溶液中,其有关的离子方程式是_____________________________________,取少量上层澄清溶液,向其中通入足量的CO2,又能重新得到相应的沉淀, 其有关的离子方程式为________________________。
(4)试配平最后一步相关的氧化还原方程式:
_____Na2Cr2O7 + ______SO2 + _______ H2O =" ______" Cr(OH)(H2O)5SO4 + ______ Na2SO4,每生成1mol Cr(OH)(H2O)5SO4时,该反应中转移的电子数为__________。
合成氨和制备硝酸是两种重要的化工生产,重庆某化工厂将合成氨与制备硝酸进行连续生产。
(1)在某温度下体积为200 L的氨合成塔中,以分为单位的时间点上测得各物质的浓度(mol·L﹣1)如下表:
| | 0 min | l min | 2 min | 3 min | 4 min |
| N2 | 1.500 | 1.400 | 1.200 | c1 | c1 |
| H2 | 4.500 | 4.200 | 3.600 | c2 | c2 |
| NH3 | 0 | 0.200 | 0.600 | c3 | c3 |
根据表中数据得知0 min~2 min内N2的平均反应速率是_______,若3 min末N2的转化率为a,则此时H2的转化率为_______ (用含a的代数式表示)。
(2)今对合成氨反应进行如下研究:在容积均为10 L的a、b、c三个相同密闭容器中分别充入1 mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5 min时,NH3的体积分数如图所示。则下列说法正确的是_______。
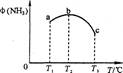
A.a、b、C三容器5 min时的正反应速率大小为:b>a>c
B.达到平衡时,a、b、c中N2转化率为a>b>c
C.5min时,a、b、c三容器中的反应均可能达到平衡状态。
D.将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压
(3)已知:N2(g)+O2(g)=2NO(g): △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=﹣905 kJ/mol
2H2(g)+O2(g)=2H2O(g); △H=﹣483.6 kJ/mol
则在该条件下,氨合成塔中所发生反应的热化学方程式为:____________________________;
(4)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,写出该反应的离子方程式:_________________________________________;
(5)取200 mL的硝酸恰好与32 g Cu2S完全反应,已知硝酸被还原成等物质的量的NO和NO2,另外还有CuSO4和Cu(NO3)2生成,则所得工业硝酸的浓度是_______mol·L﹣1。
 6Cu+SO2↑,该反应的氧化剂是______________;当生成19.2 g Cu时,反应中转移的电子为__________mol。
6Cu+SO2↑,该反应的氧化剂是______________;当生成19.2 g Cu时,反应中转移的电子为__________mol。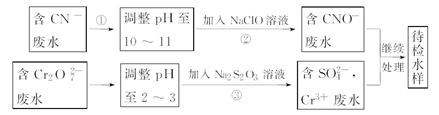
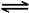 CO2(g)+H2(g) △H=-41kJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0molH2O(g),在tmin时达到平衡,测得放出了32.8kJ热量,则tmin内用H2表示的平均反应速率为 ,由此可知在该温度下反应CO2(g)+H2(g)
CO2(g)+H2(g) △H=-41kJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0molH2O(g),在tmin时达到平衡,测得放出了32.8kJ热量,则tmin内用H2表示的平均反应速率为 ,由此可知在该温度下反应CO2(g)+H2(g)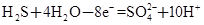 ②
②