题目内容
2.将经过酸洗除锈的铁钉,用饱和食盐水浸泡后放入如图所示的装置中,下列叙述正确是( )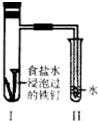
| A. | 过一段时间,Ⅱ试管中的导管内水柱上升 | |
| B. | Ⅰ试管中铁钉由于发生电解反应而被腐蚀 | |
| C. | 铁钉在该试管中的腐蚀速度越来越快 | |
| D. | Ⅰ试管中铁钉发生反应的一个电极方程式为:2Cl--2e-=Cl2↑ |
分析 铁钉中含有碳、铁,将经过酸洗除锈的铁钉,用饱和食盐水浸泡后,碳、铁和氯化钠溶液构成原电池而发生吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,碳作正极,正极上氧气得电子发生还原反应.
解答 解:A.生铁遇到氯化钠溶液发生吸氧腐蚀,导致I试管中气体压强减小,小于大气压,所以II试管中的导管内水柱上升,故A正确;
B.I试管中铁钉发生的是原电池反应,而不是电解反应,故B错误;
C.铁钉在该装置中发生吸氧腐蚀,随着氧气量的减少,则被腐蚀的情况随时间的延长而减慢,故C错误;
D.I试管中铁钉发生反应电极反应式分别为:负极 Fe-2e-═Fe 2+,正极 O2+2H2O+4e-═4OH-,故D错误;
故选A.
点评 本题考查铁的吸氧腐蚀,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点是实验现象的描述及电极反应式的书写,题目难度中等.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
7.制造水泥和普通玻璃都需要的原料是( )
| A. | 石灰石 | B. | 粘土 | C. | 纯碱 | D. | 硅酸钠 |
7.用苯酚做下列实验,能成功的是( )
| A. | 与浓硫酸和浓硝酸混合液发生硝化反应 | |
| B. | 与乙醇发生酯化反应 | |
| C. | 在80℃的水中形成乳浊液 | |
| D. | 与福尔马林在沸水浴中便可发生缩聚反应制酚醛树脂 |
14.下列与实验相关的叙述正确的是( )
| A. | 配制浓硫酸、浓硝酸的混酸时,应将浓硝酸沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 用滴定管、量筒量取5.0mL液体,俯视读数时所得液体体积均大于5mL | |
| C. | 大试管、烧瓶、锥形瓶均可用于组装气体发生装置 | |
| D. | 实验室配制一定质量分数、一定物质的量浓度的溶液时均需使用容量瓶 |
12.已知aX n+和bYm- 两种离子的电子层结构相同,则下列关系成立的是( )
| A. | a=b+n-m | B. | 离子半径Y m-<X n+ | ||
| C. | 原子序数Y>X | D. | 原子半径X>Y |
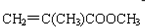 )旧法合成的反应是:
)旧法合成的反应是: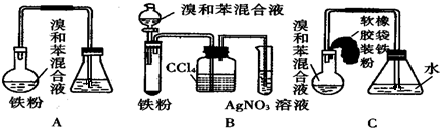
 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$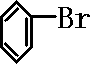 +HBr;装置A中左侧长导管的作用是导气和冷凝回流;装置A和C中的两处明显错误是锥形瓶未与大气相通、导管插入AgNO3(或水)溶液中.
+HBr;装置A中左侧长导管的作用是导气和冷凝回流;装置A和C中的两处明显错误是锥形瓶未与大气相通、导管插入AgNO3(或水)溶液中.
 (1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略溶液体积的变化),
(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略溶液体积的变化),