题目内容
【题目】氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。部分化学键的键能如下表:
化学键 | N≡N | O=O | N-N | N-H | O-H |
键能/kJmol-1 | 946 | 497 | 193 | 391 | 463 |
写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO) (丙容器/span>)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率υ(NO)=____________。
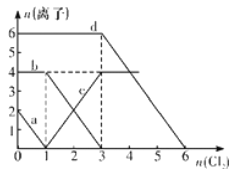
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
【答案】N2H4(g)+O2(g)=N2(g)+2H2O(g) H=-544 kJ/mol 放热 0.01mol/(L·min) = C
【解析】
(1)用H=反应物键能总和-生成物键能总和计算。
(2)根据温度对化学平衡的影响判断反应的热效应;先依据等效平衡判断乙容器平衡时NO物质的量,再根据υ=![]() 计算。
计算。
(3)根据影响化学平衡常数的因素、压强对化学平衡的影响分析作答。
(1)反应N2H4(g)+O2(g)=N2(g)+2H2O(g) H=反应物键能总和-生成物键能总和=4×391kJ/mol+193kJ/mol+497kJ/mol-(946kJ/mol+4×463kJ/mol)=-544kJ/mol,答案为:N2H4(g)+O2(g)=N2(g)+2H2O(g) H=-544 kJ/mol。
(2)①甲容器和丙容器起始加入的NO物质的量相等,根据表中数据,丙容器先达到平衡状态,则丙容器中反应速率比甲容器中快,T>400;平衡时甲容器中NO物质的量为0.80mol,丙容器中NO物质的量为1.00mol,说明升高温度平衡逆向移动,则逆反应为吸热反应,正反应为放热反应,答案为:放热。
②甲容器和乙容器的温度、容积相同,乙容器中起始加入的NO物质的量是甲容器的![]() ,该反应反应前后气体分子数不变,则乙容器与甲容器为恒温恒容下的比例等效平衡,甲容器平衡时NO物质的量为0.80mol,则乙容器平衡时NO物质的量为0.40mol;乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率υ(NO)=
,该反应反应前后气体分子数不变,则乙容器与甲容器为恒温恒容下的比例等效平衡,甲容器平衡时NO物质的量为0.80mol,则乙容器平衡时NO物质的量为0.40mol;乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率υ(NO)=![]() =0.01mol/(L·min),答案为:0.01mol/(L·min)。
=0.01mol/(L·min),答案为:0.01mol/(L·min)。
(3)①浓度平衡常数只与温度有关,A和C的温度相同,故Kc(A)= Kc(C),答案为:=。
②反应2NO2(g)+2C(s) N2(g)+2CO2(g)是气体分子数增大的反应,增大压强,平衡逆向移动,NO2的转化率减小,故A、B、C三点中NO2的转化率最高的是C点,答案为:C。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】为探究Na与CO2反应的产物,某化学兴趣小组按如图所示装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3
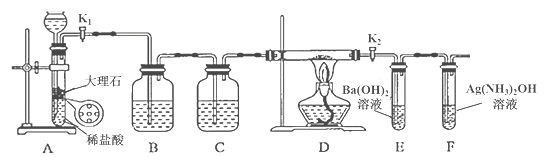
回答下列问题:
(1)B中的溶液为______________。
(2)先称量硬质玻璃管的质量为ml g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g。再进行下列实验操作,其正确顺序是____________(填标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊 e.关闭K1和K2 f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________________________;
(4)探究固体产物中钠元素的存在形式
假设一:只有Na2CO3; 假设二:只有Na2O; 假设三:Na2O和Na2CO3均有;
完成下列实验设计,验证上述假设:
步骤 | 操作和现象 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
(5)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式_____________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |