题目内容
在一固定容积的密闭容器中,进行如下化学反应:
CO2(g)+ H2(g) CO(g)+ H2O(g) △H =" Q" kJ·mol—1
CO(g)+ H2O(g) △H =" Q" kJ·mol—1
其化学平衡常数K和温度t的关系如下:
请回答:
(1)上述反应中Q 0 (选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是 。
(a) 容器中压强不变 (b) 反应热△H不变
(c)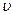 正(H2)=
正(H2)=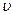 逆(CO) (d) CO2的质量分数不变
逆(CO) (d) CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g) CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
850℃时物质浓度(mol/L)的变化
①计算:3min时(CO的浓度)c1=_ _mol/L,H2O(g)的转化率= 。
②反应在4min—5min之间,平衡向逆方向移动,可能的原因是 (单选),
表中5min—6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
CO2(g)+ H2(g)
 CO(g)+ H2O(g) △H =" Q" kJ·mol—1
CO(g)+ H2O(g) △H =" Q" kJ·mol—1其化学平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)上述反应中Q 0 (选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是 。
(a) 容器中压强不变 (b) 反应热△H不变
(c)
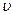 正(H2)=
正(H2)=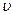 逆(CO) (d) CO2的质量分数不变
逆(CO) (d) CO2的质量分数不变(3)温度为850℃时,可逆反应CO(g)+H2O(g)
 CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:850℃时物质浓度(mol/L)的变化
| 时间(min ) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
②反应在4min—5min之间,平衡向逆方向移动,可能的原因是 (单选),
表中5min—6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(1) > (2分) (2) c d (3分)
(3)①0.08 (3分) 40% (2分) ② d (2分) a (2分)
(3)①0.08 (3分) 40% (2分) ② d (2分) a (2分)
该题是一个有关化学反应速率、化学平衡的试题,题目结合两个图表考查了应试者接受、吸收、整合化学信息的能力,要求应试者能够从试题提供的新信息中,准确地提取实质性内容,并经与已有知识块整合,运用相关知识,采用分析、综合的方法,解决简单化学问题的能力。题目还在知识层面上考查了化学平衡常数判断和应用,反应达到化学平衡状态的判断,平衡移动原因的判断。题目综合性较强,是符合山东省07年高考命题思路的好题。反应中温度升高K值增大说明正反应是吸热反应,Q >0。判断该反应已达到化学平衡状态的依据是正逆反应速率相等,参加反应的物质的质量分数不变。因为3min和4min 时气体的浓度没有发生改变,所以此时反应达到了平衡。因为在850℃时反应的平衡常数为1.0。所以应有C1× C2 ="==" C32 且C1+ C3="==" 0.200 mol/L,C2+ C3="==" 0.300 mol/L,解得:C1="==0.08" mol/L,H2O(g)的转化率为40%,反应在4min—5min之间,平衡向逆方向移动,可能是增大了氢气浓度,表中5min—6min之间数值发生变化,可能是增加了水蒸气浓度。

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
 3A(g)+B(g) 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白。
3A(g)+B(g) 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白。 H++HSO4- HSO4-
H++HSO4- HSO4- (由煤和水蒸气高温制得)应用的新方法,如:
(由煤和水蒸气高温制得)应用的新方法,如:  在443—473K的温度下用钴作催化剂,可合成碳原子数为5—8的烷烃。
在443—473K的温度下用钴作催化剂,可合成碳原子数为5—8的烷烃。 的化学方程式
的化学方程式 ,以n表示
,以n表示 的体积分数,则
的体积分数,则 、a、x的关系式为 。
、a、x的关系式为 。 mC(g),反应一段时间后,测得A的转化率是50%,此时气体的密度是反应前(同温同压)的4/3,则n和m的数值可能是( )
mC(g),反应一段时间后,测得A的转化率是50%,此时气体的密度是反应前(同温同压)的4/3,则n和m的数值可能是( )
 HCO3-+OH-。下列说法中,正确的是( )
HCO3-+OH-。下列说法中,正确的是( )
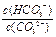 减小
减小
