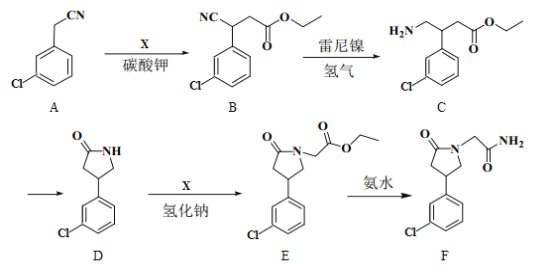
题目内容
【题目】某实验小组人员用质量分数为98%,密度为1.84g·cm-3的浓硫酸配制1L2.3mol·L-1的稀硫酸。
(1)所配制的稀硫酸中,H+的物质的量浓度与____mol·L-1的NaHSO4溶液中H+的物质的量浓度相同,NaHSO4与氢氧化钡在溶液中反应使溶液呈中性的离子方程式为_____。
(2)需量取浓硫酸的体积为_____mL。
(3)容量瓶使用前应_____。
【答案】4.6 Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O 125.0 查漏
【解析】
由电离方程式可知硫酸中H+的物质的量浓度是硫酸物质的量浓度的两倍,NaHSO4溶液中H+的物质的量浓度与NaHSO4物质的量浓度相同;通过配制前后溶质质量不变可得公式:![]() ,以此答题。
,以此答题。
(1)由电离方程式可知硫酸中H+的物质的量浓度是硫酸物质的量浓度的两倍,NaHSO4溶液中H+的物质的量浓度与NaHSO4物质的量浓度相同,故2.3mol·L-1的稀硫酸中H+的物质的量浓度为4.6mol/L,与4.6mol/L的NaHSO4溶液中H+的物质的量浓度相同;NaHSO4与氢氧化钡在溶液中反应使溶液呈中性的离子方程式为:![]() ;
;
故答案为:4.6;![]() ;
;
(2)配制前后溶质质量不变可得公式:![]() ,则浓硫酸的体积
,则浓硫酸的体积![]() ;容量瓶使用前应查漏。
;容量瓶使用前应查漏。
故答案为:125.0;查漏。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目