题目内容
【题目】(1)氢气可由天然气和水反应制备,其主要反应为CH4(g)+2H2O(g)![]() CO2(g)+4H2(g),反应过程中能量变化如图所示:
CO2(g)+4H2(g),反应过程中能量变化如图所示:
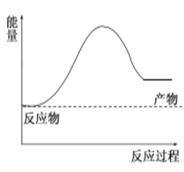
(1)若已知某些化学键的键能用字母表示如表:(计算用含a、b、c、d字母表示)。根据该反应制取1molH2要吸收或放出热量为__________
化学键 | C-H | O-H | C=O | H-H |
键能(kJ/mol) | a | b | c | d |
(2)在恒温恒容条件下反应,能说明该反应已达到平衡状态的是______________。
a.2v正(CO2)=v逆(H2O)
b.容器内密度不再发生变化
c.平均相对分子质量不再发生变化
d.当4molC-H键断裂时,同时又2molC=O键断裂
(3)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
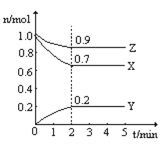
①该反应的化学方程式为__________
②反应开始至2min,气体Y的平均反应速率为__________
(4)利用2H2+O2=2H2O的燃烧反应,可以构成一个以KOH溶液作电解质溶液的燃料电池,该燃料电池的正极反应式为__________。
【答案】a+b-![]() -d acd 3X+Z
-d acd 3X+Z![]() 2Y 0.05mol·L-1·min-1 O2+4e-+2H2O=4OH-
2Y 0.05mol·L-1·min-1 O2+4e-+2H2O=4OH-
【解析】
题目中的反应需根据反应物键能与生成物的键能之间的关系进行计算,判断原电池反应的正负极需要判断反应中得失电子的物质,得电子的物质为电源正极,失电子的物质为电源负极。
(1)一个化学反应的反应热可以由反应物的键能总和减去生成物的键能总和计算,根据表格数据,该反应的反应热为+(4a+4b-2c-4d)kJ/mol,即每生成4mol氢气需要从外界吸收(4a+4b-2c-4d)kJ的能量,当生成1mol氢气时,需要吸收![]() ×(4a+4b-2c-4d)=(a+b-
×(4a+4b-2c-4d)=(a+b-![]() -d)kJ的能量;
-d)kJ的能量;
(2)a.当2v正(CO2)=v逆(H2O)时,即二氧化碳的生成速率与水的生成速率比为2:1时,可以判断化学反应达到平衡状态,a正确;
b.根据质量守恒定律,反应体系内的总质量不发生变化,反应容器的体积不变,体系中混合气体的密度恒不变,不能判断反应达平衡,b错误;
c.随着反应的不断进行,反应体系中总物质的量逐渐增大,当反应达平衡时,体系中总物质的量不再发生变化,体系中的平均相对分子质量不再发生变化,可以判断反应达平衡,c正确;
d.当断裂4molC-H键指的是CH4的消耗速率,当断裂2molC=O键指的是CO2的消耗速率,当反应物的消耗速率与生成物的消耗速率比等于化学计量数比时,可以判断反应达平衡,d正确;故选择acd;
(3)根据图示,起始时X物质为1mol,平衡时为0.7mol,消耗了0.3mol;起始时Z物质为1mol,平衡时为0.9mol,消耗了0.1mol;起始时Y物质为0,平衡时为0.2mol,生成了0.2mol,故X、Z为反应物,Y为生成物,故该反应的反应方程式为3X+Z![]() 2Y;2min内Y物质的反应速率v=
2Y;2min内Y物质的反应速率v=![]() =
= =0.05mol·L-1·min-1;
=0.05mol·L-1·min-1;
(4)利用2H2+O2=2H2O的燃烧反应,可以构成一个以KOH溶液作电解质溶液的燃料电池,反应中O2得到电子,在正极反应,故正极的反应式为O2+4e-+2H2O=4OH-。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案