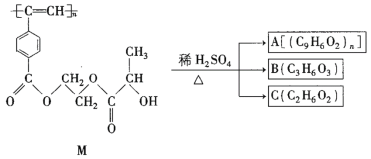
题目内容
【题目】某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
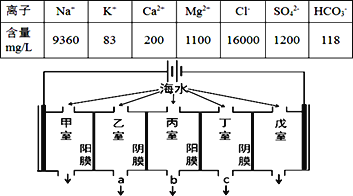
A. 甲室的电极反应式为:2Cl--2e-= Cl2↑
B. 当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
C. 乙室和丁室中部分离子的浓度增大,淡水的出口为b
D. 淡化过程中易在戊室形成水垢
【答案】B
【解析】
A、Cl-放电能力大于OH-;
B、戊室收集到22.4L即1molH2,转移电子2mol,通过甲室阳膜的阳离子有Na+、K+、Ca2+、Mg2+等;
C、阴(阳)离子交换膜只允许阴(阳)离子通过,电解时丙室中阴离子移向乙室,阳离子移向丁室,所以丙室中物质主要是水;
D、开始电解时,甲室为阳极,氯离子放电生成氯气,戊室为阴极,水得电子生成氢气同时生成OH-,生成的OH-和HCO3-反应生成CO32-,Ca2+转化为CaCO3沉淀。
A、Cl放电能力大于OH,所以阳极的电极反应式为2Cl2e=Cl2↑,故A不选;
B、戊室收集到22.4L即1molH2,转移电子2mol,而通过甲室阳膜的阳离子有Na+、K+、Ca2+、Mg2+等,所以通过甲室阳膜的离子的物质的量一定小于为2mol,故B选;
C、阴(阳)离子交换膜只允许阴(阳)离子通过,所以电解时丙室中阴离子移向乙室,阳离子移向丁室,所以乙室和丁室中部分离子的浓度增大,丙室中物质主要是水,淡水的出口应为b,故C不选;
D、开始电解时,阳极上氯离子放电生成氯气,阴极上水得电子生成氢气同时生成OH,生成的OH和HCO3反应生成CO32,Ca2+转化为CaCO3沉淀,所以电解一段时间后阴极区会发生反应:Ca2++OH+HCO3=CaCO3↓+H2O,故D不选。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案