题目内容
17.X、Y、Z都是第三周期元素,核电荷数依次增大,X的氧化物对应水化物是强碱,Z的原子半径在该周期中最小.据此判断下列说法正确( )| A. | X是第IA元素,Z是第ⅦA元素 | |
| B. | 元素X、Z形成的化合物是共价化合物 | |
| C. | Y一定是金属元素 | |
| D. | Z的最高价氧化物对应的水化物是弱酸 |
分析 X、Y、Z都是第三周期元素,核电荷数依次增大,X的氧化物对应水化物是强碱,则X是Na元素,Z的原子半径最小,为Cl元素,Y为从Na到Cl元素之间的元素,结合原子结构、元素周期律来分析解答.
解答 解:X、Y、Z都是第三周期元素,核电荷数依次增大,X的氧化物对应水化物是强碱,则X是Na元素,Z的原子半径最小,为Cl元素,Y为从Na到Cl元素之间的元素,
A.Na位于第IA族、Cl元素位于第VIIA族,故A正确;
B.X、Z形成的化合物氯化钠是离子化合物,故B错误;
C.Y为从Na到Cl元素之间的元素,Y可能是金属元素也可能是非金属元素,故C错误;
D.该周期中,Cl元素的非金属性最强,所以Z的最高价氧化物对应的水化物HClO4是强酸,故D错误;
故选A.
点评 本题考查了元素位置结构性质的相互关系及应用,熟悉元素周期表、原子结构是解本题关键,结合元素周期律来分析解答,知道离子键和共价键的区别,题目难度中等.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
7.在下列反应中,盐酸既表现还原性又表现酸性的是( )
| A. | NaOH+HCl═NaCl+H2O | B. | MnO2+4HCl(浓)═MnCl2+2H2O+Cl2↑ | ||
| C. | Fe+2HCl═FeCl2+H2↑ | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
8.下列叙述正确的是( )
| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 原子半径:Cl>S>O | ||
| C. | 稳定性:HBr>HCl>HF | D. | 金属性:Al>Mg>Na |
5.下列有关实验的叙述,正确的是( )
| A. | 溴乙烷加氢氧化钠溶液做催化剂加热水解后,再加AgNO3溶液有浅黄色沉淀生成 | |
| B. | 实验室用分液漏斗分离苯和水的混合物 | |
| C. | 可以用酸性高锰酸钾溶液除去乙烷中混有的乙烯 | |
| D. | 除去苯中的少最苯酚,可以先加浓溴水,充分沉淀后过滤即可 |
12.金刚石和石墨都是碳的单质,属于同素异形体,在一定条件下石墨可以转化为金刚石.通过实验测定:在100kPa下,12g石墨完全转化为金刚石,需要吸收1.895kJ的热能.据此在100kPa时,下列说法正确的是( )
| A. | 石墨转化为金刚石不是化学变化 | |
| B. | 石墨比金刚石稳定 | |
| C. | 1mol石墨具有的总能量比1mol金刚石的高 | |
| D. | 等质量的石墨与金刚石完全燃烧,石墨放出的能量多 |
9.2011年5月下旬揭露出的台湾食品添加剂毒害事件中的核心物质为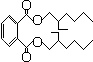 ,不法厂商将这种本是用于塑料生产的物质添加到饮料、食品中,从而造成了人类史上最大的塑化剂污染事件,下面有关该物质的说法中错误的是( )
,不法厂商将这种本是用于塑料生产的物质添加到饮料、食品中,从而造成了人类史上最大的塑化剂污染事件,下面有关该物质的说法中错误的是( )
 ,不法厂商将这种本是用于塑料生产的物质添加到饮料、食品中,从而造成了人类史上最大的塑化剂污染事件,下面有关该物质的说法中错误的是( )
,不法厂商将这种本是用于塑料生产的物质添加到饮料、食品中,从而造成了人类史上最大的塑化剂污染事件,下面有关该物质的说法中错误的是( )| A. | 分子式为C24H38O4 | |
| B. | 在NaOH溶液中水解会生成邻苯二甲酸与2-乙基-1-己醇 | |
| C. | 该物质进入人体内会有害身体健康 | |
| D. | 难溶于水,可溶于有机溶剂 |
12.两种气态烃以任意比例混合,在101kPa、105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃中符合此条件的是( )
| A. | CH4 C2H4 | B. | CH4 C3H6 | C. | C2H6 C3H4 | D. | C2H2 C3H6 |
 写出有关反应方程式
写出有关反应方程式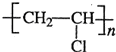
 .
.
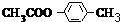 +Br2$\stackrel{光照}{→}$
+Br2$\stackrel{光照}{→}$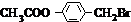 +HBr,反应③:
+HBr,反应③: .
.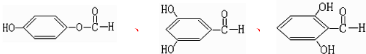 任意一种即可.
任意一种即可.