题目内容
8.下列叙述正确的是( )| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 原子半径:Cl>S>O | ||
| C. | 稳定性:HBr>HCl>HF | D. | 金属性:Al>Mg>Na |
分析 A、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
B、根据同周期元素的半径从左至右逐渐减小以及一般来说下一周期元素原子的半径比上一周期大;
C、元素的非金属性越强,对应的氢化物越稳定;
D、同一周期,原子序数越大,金属性越弱;
解答 解:A、非金属性:Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性:HClO4>H2SO4>H3PO4,故A正确;
B、同周期元素的半径从左至右逐渐减小,S>Cl,O在S的上一周期,半径最小,故B错误;
C、非金属性:F>Cl>Br,元素的非金属性越强,对应的氢化物越稳定,故C错误;
D、由于稀三种元素处于同一周期,且原子序数Al>Mg>Na,故金属性Al<Mg<Na,故D错误,故选A.
点评 本题考查较为综合,涉及到物质的稳定性、粒子半径大小的比较、酸碱性强弱等问题,但题目难度不大,注意规律的掌握.

练习册系列答案
相关题目
19.如果1g水中含有n个氢原子,则阿伏加德罗常数是( )
| A. | $\frac{1}{n}$mol-1 | B. | 9n mol-1 | C. | 2n mol-1 | D. | n mol-1 |
3.下列事实不能用勒夏特列原理解释的是( )
| A. | 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 | |
| B. | 合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率 | |
| C. | 实验室用排饱和食盐水的方法收集氯气 | |
| D. | 用铁触媒作催化剂加快化学反应速率 |
13.${\;}_{6}^{13}C$呼气法在医学上常用于门螺旋杆菌的诊断,下列关于${\;}_{6}^{13}C$的说法中正确的是( )
| A. | 质子数是6 | B. | 质量数是6 | C. | 电子数是13 | D. | 中子数是13 |
20.下列说法中不正确的是( )
| A. | 构成原电池的正极和负极不一定是两种不同的金属 | |
| B. | 用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 可逆反应2SO2+O2?2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,Qc变小,K不变,O2转化率减小 | |
| D. | 如果△H和△S均为正值,当高温时,反应可能自发进行 |
17.X、Y、Z都是第三周期元素,核电荷数依次增大,X的氧化物对应水化物是强碱,Z的原子半径在该周期中最小.据此判断下列说法正确( )
| A. | X是第IA元素,Z是第ⅦA元素 | |
| B. | 元素X、Z形成的化合物是共价化合物 | |
| C. | Y一定是金属元素 | |
| D. | Z的最高价氧化物对应的水化物是弱酸 |
3.现代家居装修材料中,普遍存在着甲醛、苯及苯的同系物等有毒物质,如果不注意处理就会对人体产生极大的危害.按照有机物官能团的分类,甲醛属于醛.下面各项对有机物的分类方法与此方法相同的是( )
| A. | 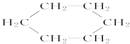 属于环状化合物 属于环状化合物 | B. |  属于卤代烃 属于卤代烃 | ||
| C. |  属于链状化合物 属于链状化合物 | D. | 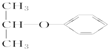 属于醚 属于醚 |
 .
.