题目内容
(10分)把0.1molMnO2粉末加入50ml过氧化氢的溶液里(密度为1.1g·mL-1),在标准状况下,放出气体的体积V和时间t的关系曲线如图所示。
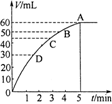
(1)实验时放出气体的体积为 。
(2)放出一半气体所需的时间约为 。
(3)A、B、C、D各点反应速率由快到慢的顺序是 。
(4)根据曲线形状解释反应速率变化的原因 。
(5)计算反应前过氧化氢的物质的量浓度

(1)实验时放出气体的体积为 。
(2)放出一半气体所需的时间约为 。
(3)A、B、C、D各点反应速率由快到慢的顺序是 。
(4)根据曲线形状解释反应速率变化的原因 。
(5)计算反应前过氧化氢的物质的量浓度
(1)60ml (2)2min (3)D.C.B.A
(4)随着过氧化氢浓度的减小,化学反应速率减小 (5)0.11mol·L-1
(4)随着过氧化氢浓度的减小,化学反应速率减小 (5)0.11mol·L-1
根据图像可知当反应进行到5min时,气体体积不再发生变化,所以实验中放出的气体体积为60ml。根据图像当反应进行到2min时,气体体积为30ml。根据图像曲线的变化趋势可以看出,最初阶段曲线的斜率最大,反应最快,随着时间的推移,反应速率逐渐减小。这是由于随着反应的进行,反应物的浓度逐渐降低,导致反应速率逐渐减小。60ml氧气的物质的量是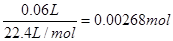 ,根据双氧水的分解方程式2H2O2=2H2O+O2↑可知消耗双氧水的物质的量是0.0054mol,所以其浓度为
,根据双氧水的分解方程式2H2O2=2H2O+O2↑可知消耗双氧水的物质的量是0.0054mol,所以其浓度为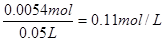 .
.
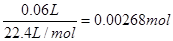 ,根据双氧水的分解方程式2H2O2=2H2O+O2↑可知消耗双氧水的物质的量是0.0054mol,所以其浓度为
,根据双氧水的分解方程式2H2O2=2H2O+O2↑可知消耗双氧水的物质的量是0.0054mol,所以其浓度为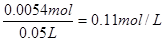 .
.
练习册系列答案
相关题目



 ;
;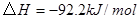 。在某段时间
。在某段时间 中反应速率与反应过程的曲线图如下,则氨的百分含量最高的一段时间是
中反应速率与反应过程的曲线图如下,则氨的百分含量最高的一段时间是 



