题目内容
在块状锌与0.5mol/LH2SO4溶液的反应中,下列实验操作不能加快氢气产生速率的是
| A.将H2SO4溶液改为浓硫酸 | B.用1mol/LH2SO4溶液代替原H2SO4溶液 |
| C.用锌粉代替块状锌 | D.用同浓度热的H2SO4溶液代替原H2SO4溶液 |
A
考查外界条件对反应速率的影响。浓硫酸具有强氧化性,和锌反应生成物是SO2,而不是氢气。B是增大反应物浓度,C是增大反应物的接触面积,D是升高温度,均可以加快反应速率。所以答案选A。

练习册系列答案
相关题目

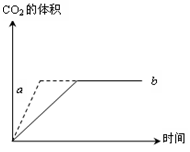
 2Z(g)+W(s),△H<0的反应过程。若使a曲线变为b曲线,可采用的措施是
2Z(g)+W(s),△H<0的反应过程。若使a曲线变为b曲线,可采用的措施是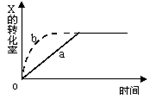
 ②如果实验过程中所用的盐酸是过量的,则所取块状石灰石与粉末状石灰石的质量是否相等?(填“相等”或“不相等”)。
②如果实验过程中所用的盐酸是过量的,则所取块状石灰石与粉末状石灰石的质量是否相等?(填“相等”或“不相等”)。