题目内容
下图表示反应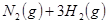

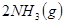 ;
;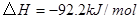 。在某段时间
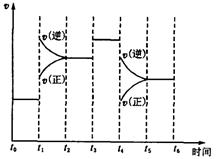
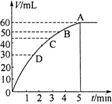
。在某段时间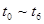 中反应速率与反应过程的曲线图如下,则氨的百分含量最高的一段时间是
中反应速率与反应过程的曲线图如下,则氨的百分含量最高的一段时间是
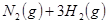

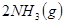 ;
;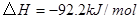 。在某段时间
。在某段时间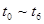 中反应速率与反应过程的曲线图如下,则氨的百分含量最高的一段时间是
中反应速率与反应过程的曲线图如下,则氨的百分含量最高的一段时间是 
A.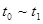 | B.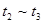 |
C.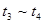 | D. |
A
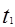 时刻改变条件,逆向速率大于正向,所以平衡逆向移动,氨的百分含量减小。
时刻改变条件,逆向速率大于正向,所以平衡逆向移动,氨的百分含量减小。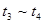 平衡没有发生移动。
平衡没有发生移动。 之后,逆向速率大于正向,平衡继续逆向移动,其含量继续减小。所以最初的平衡状态氨的百分含量最高
之后,逆向速率大于正向,平衡继续逆向移动,其含量继续减小。所以最初的平衡状态氨的百分含量最高
练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
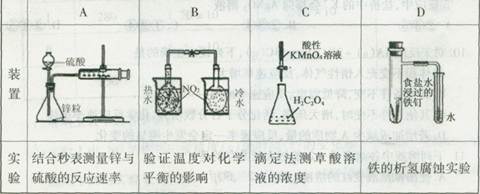
 CO(气)+H2(气)在一可变容积的闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(气)+H2(气)在一可变容积的闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )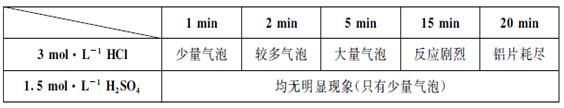
 对该反应不影响。
对该反应不影响。 出主要实验步骤。
出主要实验步骤。 2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大
2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大